مذكرة الغليان والتجمد فيزياء للصف الحادي عشر علمي الفصل الثاني إعداد أ.محمد البلاطي نقدمها لكم بأسلوب سهل وممتع للقارئ والمتعلم
مفهوم الغليان :
هو تحول المادة من الحالة السائلة إلى الحالة الغازية عند درجة حرارة معينة تسمى درجة الغليان
1 - تحدث عملية الغليان للجزيئات في باطن السائل أو تحت سطح السائل حيث يكتسب السائل حرارة وتعمل هذه الحرارة على زيادة طاقة وضع الجزيئات دون تغير في درجة الحرارة ويحدث كسر في روابط الجزيئات لتتحول المادة من الحالة السائلة إلى الحالة الصلبة
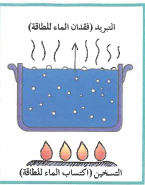
2 - يظهر الغليان على شكل فقاعات تطفو على السطح ثم تهرب إلى الهواء المحيط متحولة إلى الحالة الغازية لأن الحرارة المضافة إلى النظام تغير من الطاقة الداخلية دون إحداث تغير في درجة الحرارة فتعمل زيادة الطاقة الداخلية إلى كسر الروابط بين الجزيئات لتتحرك بحرية متحولة للحالة الغازية
3 - تحدث عملية الغليان للجزيئات عند درجة حرارة ثابتة هي درجة الغليان
4 - تحدث عملية الغليان للجزيئات بمعدلات سريعة
5 - تعتبر عملية الغليان عملية تبريد لأن الجزيئات تكتسب طاقة حركة من الجزيئات المجاورة لها لنقل طاقة حركة الجزيئات المجاورة وتنخفض درجة حرارتها
تطبيقات حياتية على الغليان :
من التطبيقات الحياتية على الغليان غليان الماء وطهو الطعام واستخدام القدور الكاتمة وغيرها
علاقة الضغط بدرجة الغليان :
1- مفهوم علاقة الضغط بدرجة الغليان
2- تطبيقات حياتية على علاقة الضغط بدرجة الغليان
مفهوم علاقة الضغط بدرجة الغليان :
1 - زيادة الضغط على السائل يعمل على رفع درجة غليان السائل لأن الذرات تتحرك بسرعات أكبر لتزيد الضغط داخل فقاعات الغاز لتتمكن من مقاومة زيادة الضغط الخارجي فيتطلب ذلك طاقة حرارية زائدة كما أن زيادة الضغط يزيد من كثافة السائل مما يجعل جزيئاته أقرب إلى بعضها البعض فتحتاج طاقة حرارية إضافية لبعثرتها فترتفع درجة الغليان
2 - بزيادة الضغط تزداد درجة الغليان والعكس صحيح بانخفاض الضغط تنخفض درجة الغليان لأن بزيادة الضغط تزداد كثافة المادة وتتقارب الجزيئات من بعضها البعض وهذا يتطلب طاقة حرارية أكبر للغليان لذلك تزداد درجة الغليان بزيادة الضغط وبانخفاض الضغط تقل كثافة المادة وتتباعد الجزيئات عن بعضها البعض وهذا يتطلب طاقة حرارية أقل للغليان لذلك تنخفض درجة الغليان بانخفاض الضغط
تطبيقات حياتية على علاقة الضغط بدرجة الغليان :
من التطبيقات الحياتية على علاقة الضغط بدرجة الغليان الآتي :
1 - تستخدم أواني الضغط أي القدور الكاتمة لطهي الطعام بشكل أسرع لأنها لا تسمح بتسرب بخار الماء مما يؤدي لزيادة الضغط داخلها حتى يصبح أعلى من الضغط الجوي المعتاد فترتفع درجة غليان الماء فتعمل على طهي الطعام بسرعة
2 - يفضل استخدام القدور الكاتمة في طهو الطعام لأنها تعمل على زيادة الضغط داخل الإناء مما يزيد من درجة غليان الماء فيسهل طهو الطعام لأن عملية الغليان تعتبر تبريد لباقي جزيئات السائل وبالتالي عند تأخر الغليان تحتفظ المياه بطاقة حرارية أكبر لتسهيل عملية الطهو
3 - يصعب طهو الطعام في أعالي الجبال أو تفضل القدور الكاتمة في أعالي الجبال والمناطق المرتفعة في طهو الطعام بسبب انخفاض الضغط مما يعمل على خفض درجة الغليان
4 - ارتفاع درجة حرارة الماء عن درجة 100C باستخدام أواني الضغط لأن أواني الضغط تزيد الضغط فترتفع درجة حرارة الماء باستمرار دون حدوث الغليان مما يؤدي إلى طهي الطعام بشكل أسرع
5 - ثبات درجة غليان الماء عند 100C بالرغم من استمرار التسخين لأن عملية الغليان مثل التبخر يصاحبها عملية تبريد بنفس المعدل فتظل درجة الحرارة ثابتة عند درجة الغليان لأن معدل التدفئة الناتجة من التسخين يساوي معدل التبريد الناتج من الغليان في الضغط الجوي المعتاد كالآتي :
مفهوم التجمد :
1 - هو تحول المادة من الحالة السائلة إلى الحالة الصلبة بخفض درجة الحرارة أي بالتبريد
2 - عند تناقص الطاقة تقل حركة الجزيئات فتقوم قوى التجاذب بين الجزيئات بالتأثير عليها فتتقارب وتهتز في مواضع ثابتة متحولة للحالة الصلبة حيث يتكون الثلج أي حالة صلبة نتيجة فقدان الماء أي حالة سائلة حرارة وذلك عند درجة تجمد الماء وهي 0C عند الضغط الجوي المعتاد
3 - عندما يحدث التجمد فإن الجزيئات تتقارب مع بعضها البعض لكي تكون الحال الصلبة كذلك الماء عندما يتجمد فإن الجزيئات تتقارب مع بعضها البعض لتكون بلورات الثلج لكن عند رش بعض المواد المذابة في الماء مثل السكر أو الملح فإن هذه المواد تعترض الجزيئات أثناء تقاربها لتكوين بلورات الثلج مما يعمل على خفض درجة التجمد وبالتالي تصبح درجة تجمد الماء أٌل من الصفر سيليزيوس
4 - عند إضافة بعض المواد للماء مثل الملح أو السكر أو الاثيلين جليكول يخفض من درجة تجمده لأن جزيئات المادة المضافة تدخل بين الجزيئات للماء فتباعد بينها وعملية التجمد تقارب بين الجزيئات فتتطلب تبريداً إضافياً لكي تجمد السائل كالآتي :
تطبيقات حياتية على التجمد :
من التطبيقات الحياتية على التجمد الآتي :
1 - ترش الطرق المتجمدة بالسكر أو الملح لتخفض من درجة التجمد وبالتالي يتحول الثلج إلى ماء ويفتح الطريق
2 - في البلاد الباردة عند سقوط المطر يتم رش الملح في الطرق لأن حبيبات الملح تدخل في المسافات البيئية للماء فتمنع من تجمده إلا بانخفاض أكثر في درجة الحرارة
3 - في البلاد الباردة يضاف بعض المواد مثل الإيثيلين جيلايكول إلى راديتير أو مبرد السارة ليعمل على خفض درجة تجمد الماء وبالتالي تظل الماء داخل الراديتير أو المبرد في الحالة السائلة ولا تتحول إلى الحالة الصلب لمنع تجمد الماء حيث يعمل الإيثيلين جيلايكول على إبعاد الجزيئات عن بعضها
مفهوم علاقة الضغط بدرجة الحرارة :
بزيادة الضغط تنخفض درجة التجمد و العكس صحيح بانخفاض الضغط تزداد درجة التجمد لأن بزيادة الضغط تزداد كثافة المادة وتتقارب الجزيئات من بعضها البعض وهذا يتطلب طاقة أقل للتجمد لذلك تنخفض درجة التجمد بزيادة الضغط وبانخفاض الضغط تقل كثافة المادة وتتباعد الجزيئات عن بعضها وهذا يتطلب طاقة أكبر للتجمد لذلك تزداد درجة التجمد بانخفاض الضغط
مفهوم إعادة تجمد الماء :
هي ظاهرة الانصهار تحت تأثير الضغط ثم العودة إلى التجمد بعد زوال أو انخفاض الضغط
تطبيقات حياتية على إعادة تجمد الماء :
من التطبيقات الحياتية على إعادة تجمد الماء كالآتي :
1 - عند وضع حبل معلق به ثقلين على قطعة من الثلج فإن الحبل يزيد الضغط ويخفض درجة التجمد أو الانصهار فينصهر الثلج ويتحول إلى ماء حيث بعد زوال الضغط وهبوط السلك داخل قطعة الجليد يعود الماء مرة أخرى إلى التجمد وبالتالي يمر السلك في قطعة الثلج دون أن يكسرها
2 - عند الضغط على قطعتي الثلج فإن درجة الانصهار تنخفض وتتحول قطعتي الثلج إلى ماء وعند زوال الضغط يحدث إعادة تجمد وتلتصق قطعتي الثلج ببعضها البعض كالآتي :
3 - تفسير عملية إعادة التجمد عند تشكيل كرة الثلج لأن ضغط اليدين المبذول على الثلج يخفض نقطة ذوبان الثلج فينصهر وعند زوال الضغط يتجمد فيأخذ شكل كرة الثلج :

