حل بنك أسئلة كيمياء للصف الثاني عشر الفصل الثاني اعداد احمد عادل
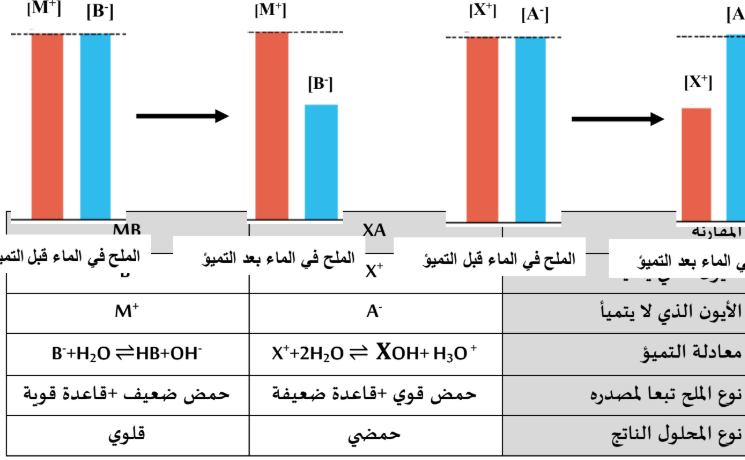
والمطلوب: أ ) أكمل الجدول التالي:
ب)- فسر ملا يلي:
(1 ) يقل تركيزأيون ]X ]في محلول الملح الأول
- تتفاعل كاتيونات X لتكون قاعد ضعيفة
(M ( ( 2 )يبقي تركيزأيون ][ في محلول الملح الثاني ثابت لا يتغير.
- لا تتفاعل كاتيونات+Mمع الماء لأنها تكون قاعدة قوية تتفكك تماما في الماء
.تمت معايره mL 20 من محلول هيدروكسيد الكالسيوم 2(OH(Ca باستخدام حمض الهيدروكلوريك تركيزه
M 5.0 وعند تمام التفاعل استهلك 25mL من الحمض احسب تركيزمحلول هيدروكسيد الكالسيوم .

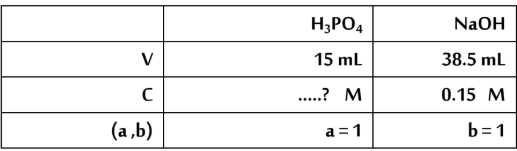
-.اضيف mL 15 من حمض الفوسفوريك H3PO4 الى mL 5.38 من محلول هيدروكسيد الصوديوم
NaOHبتركيز M 15.0 احسب التركيز المولارى لحمض الفوسفوريك اذا حدث طبقا للتفاعل التالى
H3PO4(aq)+ NaOH(aq)→NaH2PO4(aq)+ H2O(l)
-.احسب تركيز كاتيونات الرصاص وانيونات الكبريتات في المحلول المشبع المتزن لكبريتات الرصاصPbSO4II
عند درجه حرراه C7 -25 علما بان ((Ksp(PbSO4)= 6.3 x 10
معادلة تفكك كبريتات الرصاص في محلوله املشبع :SO4-+ 2 :2+ PbaSO4

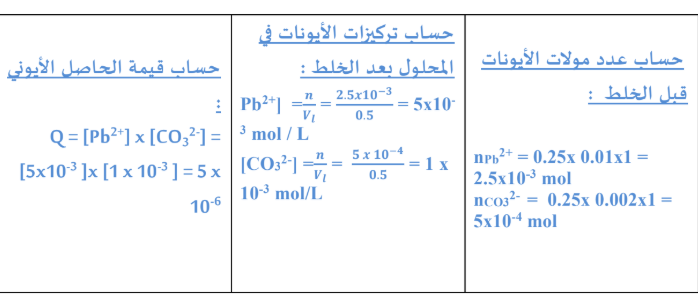
-.توقع (مع التوضيح حسابيا) اذا كان هناك راسب لكربونات الرصاص PbCO3عند اضافه (25L.0 (من
محلول نترات الرصاص 2)NO3(Pb تركيزه M 01.0 الى (25L.0 (من محلول كربونات الصوديوم Na2CO3
تركيزه M 002.0 للحصول على محلول حجمه (5L.0)
علمابأن ( 14Ksp(PbCO3)= 3.3 x 10)
معادلة تفكك كربونات الرصاص في محلوله المشبع CO3- + 2 2+ PbCO3
حل بنك أسئلة كيمياءللصف الثاني عشر الفصل الثاني اعداد احمد عادل
-وضح كيف يقاوم المحلول المنظم االمكون من(NH4Cl/NH3 )قيمه pH عندما تضاف اليه كميه من قاعده
قويه مثلNaOH( وضح اجابتك مستعينا بالمعادلات الكيميائية )
+ + NH4 O OH- NH3 +H2
- +Cl + NH4Cl NH4
+Na NaOH OH - +القاعدة قوية تتأين تماما في الماء
يتحد أنيون الهيدروكسيد من القاعدة المضافة مع كاتيونات الأمونيوم الموجودة في المخلوط مكون محلول
- الأمونيا وهو الكتروليت ضعيف OH- + + NH4 NH3 +H2O
وبذلك يقل تأثيرانيون الهيدروكسيد المضاف لذا تبقى قيمه الأس الهيدروجيني ثابته تقريبا
2-اختراربعه فقط من العمود (أ) مايناسب اتمام التفاعلات في العمود (ب) ثم اكتب الرقم امام كل تفاعل

- تفكك الإلكتروليت الضعيف ...يقل ..عند اضافه احد ايوناته لمحلوله المشبع المتزن
8 )عند تعادلmL 50 من حمض الهيدروكلوريك مع mL 100 من هيدروكسيد الصوديوم تركيزه M 05.0 فان
M.....0.1.... تركيزحمض الهيدروكلوريك
- تساعد منحنيات المعايرة على تحديد ...نقطه التكافؤ ... واختيار الدليل المناسب للمعايرة
...+HBr )10 + ....C6H5Br ماده محفزه C6H6 +Br
إذا تفاعلت كميات متكافئة من KOH مـع HCOOH ، فإن المحلول المائي الناتج عنهما ...قاعدي . التأثير
إذا كان تركيز آنيون الفلوريد F ] في محلول مشبع متزن من فلوريد الكالسيوم CaF2 يساوي M 14.- 12) 9x10.4 ...16 -x10فإن قيمة ثابت حاصل الإذابة للمركب يساوي.....
- عند تعادل ( mol 03.0 ) من هيدر وكسيد الصوديوم مع حمض الكبريتيك تركيزه ( 3.0 ، ) فإن ذلك يلزم
حجما قـدره L... 05.0 ...من الحمض حسب التفاعل التالي :H2SO4 + 2NaOH → Na2SO4 + 2 H2O
- الأسـم الشائع للمركب العضـوي CH3 ─ CHBr ─ CH2-CH3 هو..بروميد البيوتيل الثانوي ...
- قيمه الأس الهيدروجينيpH تكون اكبرمن (7 )لمحلول اسيتات الصوديوم (CH3COONa )بسبب تميؤ ايون
CH3COO... الأسيتات .
- يمكن الحصول على محلول منظم قاعدي بخلط محلول كلوريد الأمونيوم ومحلول NH3...الأمونيا ....
- التفاعلات بين الأحماض والقواعد تكون ..طارده ..للحرراه
- الصيغة العامة لهاليد الألكيل الثانوي .....X-2CH) R...)
السؤال الرابع : – ماذا تتوقع ان يحدث في كل من الحالات التالية
- اضافه حمض الهيدروكلوريك الى محلول هيدروكسيد المنجنيز( OH ( Mn الشحيح الذوبان في الماء
الحدث : (ذوبان /ترسيب )...ذوبان .....
يتحد انيون الهيدروكسيد مع كاتيون الهيدرونيوم مكون الماء الكتروليت ضعيف
السؤال الثاني: اكتب كلمه صحيحه امام العبارة الصحيحة وكلمه خطا امام العبارة غيرالصحيحة في كل مما يأتي :
-يذوب محلول هيدروكسيد النحا س 2II)OH(Cu عند اضافه محلول الأمونيا اليه نتيجة لتأثيرالأيون المشترك.(خطأ)
-للمحاليل المنظمه دورا اساسيا في الحياه منها حاجه الأنزيمات الى وسط تكون فيه قيمه الأس الهيدروجينى ثابته تقريبا حتى تعمل بنشاط . (صحيحه)
-عدد مولات هيدروكسيد الصوديوم NaOH التى تحتاج لمعادله(mol 2.0 ) من (0.4 mol) تساوى HNO3 حمض النتريك (خطأ)
السؤال الثالث : املأ الفراغات في الجمل والعبارات التالية بما يناسبها علميا :
1 ) -عند اضافه محلول الأمونيا الى هيدروكسيد النحاس 2II)OH(Cu في الماء فانه ....يذوب ....
2 ) -يمكن الحصول على محلول منظم عند خلط محلول من اسيتات الصوديوم و..حمض الأسيتك ....
3 ) - عند الوصول الى نقطه التكافؤ فيالمعايرة فان عدد مولات كاتيونات هيدرونيوم الحمض ...يساوى ..عدد مولات انيونات هيدروكسيد القاعد
4 ) -اذا كان المحلول المائي لملح سيانيد البوتاسيوم (قاعدي ) التأثيرفان ذلك يدل على ان قيمه ثابت تأين Ka القاعدةKb... اكبر.. ....من قيمه ثابت تأين الحمض
5 ) -اذا كان قيمه ثابن حاصل الإذابة لكبريتيد الفضةAg2S-5110 8x) = Ag2S(Ksp} فان تركيز انيون الكبريتيد في المحلول....M-17..... 1.26x 10
6 )-عدد مولات هيدروكسيد الصوديوم التي تحتاج لمعادله 2.0 مول من حمض النتريك .... 2.0 مول.......

