نموذج الاختبار القصير1 محلول كيمياء حادي عشر علمي فصل أول #أ. أحمد حسين 2023-2024
السؤال : أكتب بين القوسين المصطلح العلمي الذي تدل عليه من العبارات التالية :
1- منطقة من الفراغ المحيطة بالنواة و التي يكون أكبر احتمال لتواجد الالكترونِ فيها الفلك الذري
2- نظرية تفترض أن الإلكترونات تشغل الافلاك الذرية في الجزيئات رابطة التكافؤ
3- نظرية تفترض تكوين فلك جزيئي من تداخل افلاك ذرية و يغطي هذا الفلك النواة المترابطة الفلك الجزيئي
4- تداخل فلكين ذرتين رأسا لرأس المحوري
5- تداخل فلكين ذرتين جنبا لجنب عندما يكون محورا الفلكين متوازين الجانبي
6- رابطة تساهمية تنشأ عن تداخل فلكي ذرتين رأسا لرأس رابطة سيجما
7- رابطة تساهمية تنشأ عن تداخل فلكي ذرتين جنبا لجنب رابطة باي
8- الافلاك الناتجة عن عملية خلط أو اندماج بين الافلاك الذرية بوجود طاقة كافية و ذات خواص وسطية بين الافلاك المندمجة اللغلاك المهجنة
9- عملية اندماج الافلاك الذرية بوجود طاقة كافية لإنتاج أفلاك ذرية ذات خواص وسطية بين الافلاك المندمجة عملية التهجين
10- تهجين ينتج عن اندماج فلك S مع ثلاث أفلاك من P لينتج أربعة أفلاك مهجنة التهجين sp3
11- تهجين ينتج عن اندماج فلك S مع ثلاث أفلاك من P لينتج ثلاث أفلاك مهجنة التهجين sp2
12- تهجين ينتج عن اندماج فلك S مع ثلاث أفلاك من P لينتج أربعة فلكين مهجنة التهجين sp
13- جزيء يعتبر أصل المركبات الاروماتية و تكون ذرات الكربون الستة فيه متكافئة من حيث طول الرابطة و الزاوية بين الروابط البنزين
السؤال : املأ الفراغات في الجمل و العبارات التالية بما يناسبها علميا
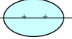
1- يمثل الشكل الفراغي ( الرسمة في الأعلى ) التالي فلك جزيئيا ناتجا عن تداخل فلكي S مع S
2- إذا علمت ان ( 17Cl , 1H ) فإن نوع الافلاك الداخلة في تكوين الرابطة بين ذرتين الهيدروجين و الكلور في الجزيء HCl هما 3Pz مع 1S
3-تنتج الرابطة التساهمية باي π عن التداخل الجانبي
4- عندما يتداخل فلكين رأسا فإن الرباطة التساهمية المتكونة بينهما تسمى رابطة سيجما
5- الرابطة التساهمية باي π أضعف من الرابطة التساهمية سيجما σ
6- رابطة تساهمية تتألف من رابطة σ و رابطتين π تسمى الثلاثية
7- عدد الروابط π في الجزيء التالي N ≡ N يساوي 2
8- يعتبر محور تداخل الفلكين في الرباطة التساهمية سيجما هو محور تناظر
9- من انماط التهجين 3sp و sp2 و sp
10- قيمة الزاوية بين الروابط في جزيء الايثين 120 بينما تكون قيمتها في جزيء الإيثاين 180
11- نوع التهجين في ذرة الكربون المشار إليها في المركب التالي : هو sp2
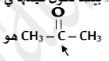
12- تترتب ذرات الكربون الستة في جزيء البنزين في شكل مستوى حلقة سداسية
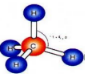
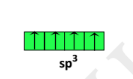
13- يمثل الشكل التالي نمط التهجين sp3
14- نمط التهجين في BF3 هو sp2. وفي SiH4 هو sp3
15- قيمة الزاوية في جزيء الماء هي 104.5
16- ترجع الخواص العامة للماء مثل ارتفاع درجة الغليان و الروابط الهيدروجينية
17- من الخواص الهامة للماء ارتفاع درجة الغليان و ارتفاع درجة التبخير و ارتفاع التوتر السطحي و انخفاض الضغط البخاري
السؤال : إشارة ( √ ) في المربع المقابل للإجابة الصحيحة في كل مما يلي :
1- تنتج الرابطتين ( π ) في جزيء ثنائي الذرية ( N2 ) من التداخل بين فلكين يوازيان فلكين من الذرة الاخرى لنواتين متجاوزتين هما :
أ- ( Py . py )
ب- ( 1S. 1S )
ج- ( Px. Px )
د- (Py . py ) . ( Pz .Pz ) ( صح )
2- الزوايا بين الافلاك المهجنة SP3 تساوي
أ- 109.5 ( صح )
ب- 180
ج- 120-
د- 107
3- نوع الرابطة بين ذرات الكربون و الهيدروجين في جزيئ البنزين
أ- باي
ب- سيجما ( صح )
ج- أيونية
د- هيدروجينية
4- يكون نوع التهجين لذرة المار إليها من النوع SP في أحد المركبات التالية

5- نوع الرابطة بين ذرتي الكريون في جزيء البنزين
أ- رابطتين سيجما
ب- رابطة سيجما و رابطة باي ( صح )
ج- روابط هيدروجينية
د- رابطتين باي
6- يكون تهجين ذرة الكربون في جزيء CH2Cl2 من النمط
أ- sp
ب- sp4
ج- sp2
د- sp3 ( صح )
7- يأخذ جزيء الايثاين في الفراغ شكلا
أ- رباعي السطوح
ب- خطيا ( صح )
ج- مستوى مثلتي
د- كرويا
8- تترتب ذرات الكربون الستة في جزيء البنزين في شكل مستوى حلقي سداسي يصاحبه سحابة ناتجة من تداخل إلكترونات الرابطة باي π
أ- اسفل الحلقة
ب- أعلى الحلقة
ج- وسط الحلقة
د- أعلى و أسفل الحلقة ( صح )
9- تتجمع جزيئات الماء القطبية مع بعضها بروابط
أ- ايونية
ب- تساهمية
ج- هيدروجينية ( صح )
د- تناسقية
السؤال : قارن بين كل مما يلي :
| وجه المقارنة | C- H≡ C-H | H2C=CH2 |
| عدد الروابط σ في الجزئ | 3 | 5 |
| عدد الروابط π بين ذرتي الكربون | 2 | 1 |
| نوع التهجين بين ذرتي الكربون | Sp | Sp2 |
| وجه المقارنة | الرابطة سيجما σ | الرابطة باي π |
| نوع التداخل | المحوري | الجانبي |
| طول الرابطة | اقصر | أطول |
| قوة الرابطة | أقوى | اضعف |
| محور التداخل | محور تناظر | محور الفلكين متوازيين |
| سهولة الكسر | صعبة الكسر | سهلة الكسر |
| نوع التفاعلات الكيميائية | الاستبدال | الاضافة |
| وجه المقارنة | CH4 | C2H4 |
| نوع التهجين | SP3 | SP2 |
| عدد الروابط σ | 4 | 5 |
| الشكل الفراغي | رباعي السطوح | مستوى مثلثي |
السؤال : مقارنة بين انماط التهجين
| sp | 2 Sp | Sp3 | نوع التهجين / الخاصية |
الايثاين C2H2 | الايثين C2H4 | الميثان CH4 | مثال الصيغة الجزيئية |
| H – C ≡ C – H | 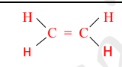 | 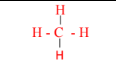 | الصيغة التركيبية ( البنائية ) |
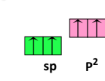 | 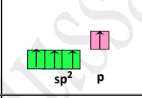 |  | التوزيع الإلكتروني لإلكترونات مستوى التكافؤ لذرة الكربون |
| 2 | 3 | 4 | عدد الافلاك المتسخدمة في التهجين ( المهجنة ) |
| 2 | 1 | لا يوجد | عدد افلاك p غير المهجنة |
| 3 | 5 | 4 | عدد الروابط σ |
| 2 | 1 | لايوجد | عدد الروابط π |
| 180 | 120 | 109.5 | الزاوية بين الروابط H - C |
| مستوى خطي | مستوى مثلثي | هرمي رباعي السطوح | الشكل الفراغي للأفلاك المهجنة |
| رابطةثلاثيةورابطة أحادية ≡ C – ( 2 سيجما , 2 باي ) |  | 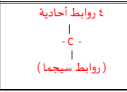 | أنواع الروابط التساهمية حول ذرة الكربون |
السؤال : اكمل ما يلي :

-لديك جزيء الاسيتاميد
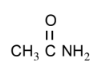
و المطلوب
| 1 | عدد الروابط سيجما σ في الاسياميد | 8 |
| 2 | عدد الروابط باي π في الاسياميد | 1 |
| 3 | نوع التهجين في ذرة كربون مجموعة الكربوتيل ( co- ) | SP2 |
| 4 | نوع التهجين في ذرة كربون مجموعة الميثيل (- CH3 ) | SP3 |
| 5 | نوع التداخل بين افلاك ذرة النيتروجين و ذرة الكربون | محوري |
| 6 | نوع التداخل بين أفلاك ذرة الاكجسين و ذرة الكربون | محوري وجانبي |
| 7 | نوع التداخل بين أفلاك ذرة الهيدروجين و ذرة الكربون | محوري |
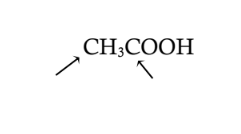
السؤال : حدد التهجين في كل من ذرتي الكروبن في جزيء حمض الاسيتيك
السؤال : علل لما يلي تعليلا علميا صحيحا
1- لا يمكن تحديد مكان الإلكترون و سرعته بدقة تامة في الوقت نفسه
الجواب : لأن الحركة الموجية للإلكترون ليس لها مكان محدد
2- لا تكون الغازات النبيلة ( الخاملة ) روابط
الجواب : لأن أفلاك ذرة الغاز النبيل لا تحتوي على إلكترون مفرد فيها
3- لا يمكن الاعتماد على نظرية رابطة التكافؤ لتفسير الترابط في بعض الجزيئات مثل CH4
الجواب : لانه بحسب نظرية رابطة التكافؤ لا تستطيع ذرة الكربون Cتكوين أكثر من رابطتين تساهميتين لأنها لا تحجتوي إلا على الكترونين مفردتين C:1S2S*2 2P2 ولكن ثبت بالتجربة العلمية ان ذرة الكربون تستطيع تكوين اربع روابط تساهمية كما في جزيء CH4
4- التهجين في الميثان SP3
الجواب : لانه يحدث تداخل محوري بين أفلاك الكربون الاربعة المهجنة SP3 و الفلك Sفي ذرات الهيدروجين الاربعة
5- حلقة البنزين متماسكة
الجواب : لوجود الروابط σ القوية والتي تبقى الحلقة متماسكة
6- يعتبر جزيء البنزين جزيئا مستقرا
الجواب : بسبب عدم التمركز التام في نظام باي والذي ينتج عن التداخل الجانبي للافلاك الذرية Pzمن الاتجاهين +أو -
7- يعتبر جزيء الماء H2O جزئا قطبيا
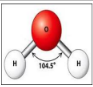
الجواب : لان الاكسجين أكثر سالبية كهربائية من الهيدروجين و بالتالي يجذب زوج الإلكترونات المكون للرابطة التساهمية O - H و تظهر شحنة سالبة جزئيا على ذرة الاكسجين فيما تظهر شحنة موجبة جزئيا على ذرة الهيدروجين
8- قطبيةالروابط في جزئ الماء لاتلغي بعضها على الرغم من أنهامتساوية
الجواب : لا نها تأخذ شكلا زاويا يعطي جزيء الماء ككل الخاصية القطبية
9- ارتفاع درجة غليان وحرارة التبخير و التوترالسطحي والسعة الحرارية النوعية وانخفاض الضغط البخاري للماء
عن المركبات المشابهة له ( مثل H2Se , H2S )
الجواب : لأن جزيئات الماء القطبية تتجمع مع بعضها عن طريق الرابطة الهيدروجينية
10- يتميز الماء بقدرة على الإذابة
الجواب : لان قيمة ثابت العزل الخاصة به مرتفعة وبالتالي تقوم جزيئات الماء القطبية بعزل الايونات المختلفة في الشحنة للمذاب عن بعضها البعض و بالتالي تفصلها عن بعضها البعض و تحدث عملية الإذابة
11- تكون ماء التبلر
الجواب : في بعض الحالات يكون اتحاد ايونات الملح بجزيئات الماء قويا جدا لدرجة ان الملح عندما يتبلر في المحلول المائي تنفصل بلوراته و تتحد مع الماء مكونة مايعرف بماء التبلر
12- لا يوجد الماء كيميائيا في صورة نقية
الجواب : لانه يذيب الكثير من المواد التي تتواجد معه
13- جزيئات الماء في حالة مستمرة
الجواب :بسبب طاقتها الحركية
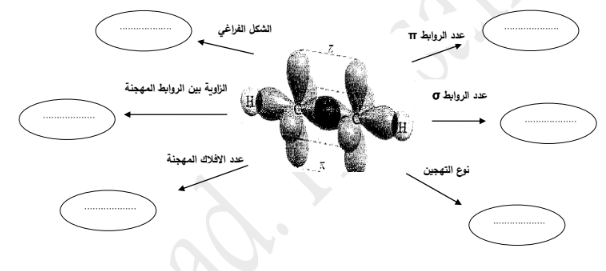
السؤال : أكمل خريطة المفاهيم التالية :
.