بنك أسئلة كيمياء ثاني عشر علمي فصل أول 2021 نقدمه لكم بأسلوب سهل وممتع للقارئ و المتعلم
السؤال الأول : اكتب الاسم أو المصطلح العلمي الذي تدل عليه كل من العبارات التالية :
1 - علم يدرس أحوال الطقس ، ويحاول توقعها بتحليل مجموعة من التغيرات أهمها الضغط الجوي ( الأرصاد الجوية )
2 - يتناسب الحجم الذي تشغله كمية معينة من الغاز تناسباً عكسياً مع ضغط الغاز عند درجة حرارة ثابتة ( قانون بويل )
3 - أقل درجة الحرارة عندها متوسط الطاقة الحركية لجسميات الغاز تساوي = صفر نظرياً. ( الصفر المطلق )
4 - يتناسب حجم كمية معينة من الغاز تناسباً طردياً مع درجة الحرارة المطلقة بالكلفن عند ثبات الضغط و كمية الغاز ( قانون تشارلز )
5 - عند ثبات الحجم فإن ضغط كمية معينه من الغاز يتناسب طردياً مع درجة حرارتها المطلقة ( قانون جاي لوساك )
6 - غاز افتراضي يخضع لقوانين الغازات و فرضيات النظرية الحركية ( الغاز المثالي )
7 - غاز يمكن اسالته وتحويله الى الحالة الصلبة بالتبريد تحت تأثير الضغط ( الغاز الحقيقي )
8 - الحجوم المتساوية من الغازات المختلفة عند درجة الحرارة و الضغط نفسيهما تحتوي على أعداد متساوية من الجسميات. ( فرضية أفوجادرو )
9 - الحجم الذي يشغله المول الواحد من غاز مثالي عند درجة الحرارة و الضغط القياسيين ويساوي 22.4 L ( الحجم المولي )
10 - عند ثبات الحجم و درجة الحرارة يكون الضغط الكلي لخليط من عدة غازات لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزئية للغازات المكونة للخليط ( قانون دالتون للضغوط الجزئية )
السؤال الثاني :
ضع علامة ( صح ) بين القوسين المقابلين للعبارة الصحيحة وعلامة ( خطأ ) بين القوسين المقابلين للعبارة غير الصحيحة في كل من الجمل التالية :
1 - إذا كان الضغط الجزئي لغاز النيون ( 100 Kpa ) والضغط الكلي في الوعاء الذي يحتوي على خليط من النيون و الهيليوم يساوي ( 300 Kpa ) فإن الضغط الجزئي لغاز الهيليوم يساوي ( 200 Kpa ) ( صح )
2 - بالون حجمه ( 2L) به عينه من غاز الهيليوم عند درجة ( 273 K ) ، فإذا ظل الضغط ثابتاً وتغيرت درجة الحرارة إلى ( 323 K ) فإن حجم البالون يصبح ( 1.72 L ) ( خطأ )
3 - غازين افتراضيين (A,B) ، إذا تساوى الضغط الجزئي لكل منهما في وعاء ما ، فإن عدد الجسيمات كل منهما في هذا الوعاء متساوي ( صح )
4 - درجة الحرارة التي عندها متوسط الطاقة الحركية لجسيمات الغاز تساوي صفراً عند ثبات الضغط وكمية الغاز هي 0 مئوي ( خطأ )
5 - كمية من الغاز ضغطه (60 kpa ) ودرجة حرارة ( 27 C ) فإذا أصبحت درجة الحرارة (600k ) مع ثبوت الحجم فإن الضغط يساوي (30.25kpa ) ( خطأ )
6 - أدخل وعاء (8 g ) من غاز الميثان 4CH (M.wt=16 ) إلى وعاء حجمه ( 3 L ) عند C 27 فإن الضغط يساوي (415.5 kpa ) علما بان (R=8.31) ( صح )
7 - يشغل (0.5 mol ) من الغاز المثالي في الظروف القياسية حجما قدره (0.5 L) ( خطأ )
8 - إناء حجمه ( 8L) وضع فيه (0.5mol) من غاز الهيليوم، (0.2mol) من غاز الاكسجين فيكون حجم غاز الهيليوم في الإناء يساوي (8L) ( صح )
9 - عينة من غاز النيون تشغل حجما قدره (400 mL) عند درجة حرارة (300K) فإذا ظل ضغطها ثابتاً، فإن درجة الحرارة بالدرجة السيليزية اللازمة ليصبح حجمها (800mL) تساوي 150C ( خطأ )
10 - عند خفض درجة الحرارة المطلقة لغاز مثالي إلى النصف وعند ثبوت الضغط فإن حجمه يقل لنصف. ( صح )
السؤال الرابع :
أكمل الفراغات في الجمل والمعادلات التالية بما يناسبها :
1 - الغازات قابلة للانضغاط بسبب وجود ...........فراغات.............. بين جزيئاتها.
2 - إذا سمح للهواء بالخروج من إطار مطاطي لدراجة فإن الضغط داخله ..........يقل...............
3 - عند خفض الضغط إلى الثلث على وعاء يحوي 3 لتر من الغاز فإن حجمه يصبح …………9……..لتر
4 - درجة الحرارة تساوي عندها متوسط الطاقة الحركية لجسيمات الغاز صفراً نظرياً تساوي على التدريج المئوي ………273c - ……
5 - إذا كان ضغط الهواء داخل إطار سيارة يساوي ( 2836 kPa ) وعند درجة ( C27 ) فإذا زاد الضغط داخل الإطار إلى ( 3241 kPa ) نتيجة الحركة ، فإن درجة الحرارة تكون ........… 69.84.......
السؤال الخامس :
علل لما يأتي :
1 -لا وجود للغاز المثالي :
لأنه لا يوجد غاز يخضع لجميع قوانين الغازات تحت أي ظروف من الضغط ودرجة الحرارة نظراً لوجود حجم وقوى تجاذب بين الجزيئات صغيرة جداً
2- يأخذ الغاز شكل الاناء الحاوي له :
لا توجد قوة تجاذب او تنافر بين جسيمات الغاز فتتحرك جزيئات الغاز بحرية داخل الاناء.
3- يتسرب الغاز من الفتحات مهما كانت صغيره :
لأن جسيمات الغاز صغيرة جداً.
4 - تستخدم الغازات في الوسائد الهوائية لحماية الركاب في حوادث السيارات :
لأنها تمتص طاقة الاصطدام بفضل قابلية الغاز للانضغاط باقتراب جسيماته من بعضها
5- تصعد كتل الهواء الساخن فوق كتل الهواء البارد :
لأن كثافة الهواء الساخن أقل من كثافة الهواء البارد
6 - عند الضغط على صمام عبوة الرذاذ ينتقل الهواء الى الخارج :
لأن الغاز ينتقل من الضغط المرتفع داخل العبوة إلى الضغط المنخفض خارج العبوة
7 - الغاز قابل للانضغاط :
لأن المسافة بين جسيمات الغاز كبيرة جداً
8 - تتحرك جسيمات الغاز بحرية داخل الوعاء :
لأن المسافة بين جسيمات الغاز كبيرة جداً وقوى التجاذب صغيرة جداً
9 - بالرغم من حدوث تصادمات بين جسيمات الغاز لكن متوسط الطاقة الحركية يظل ثابت :
لأن التصادمات بين جسيمات الغاز تصادمات مرنه.
السؤال السادس :
1 - عينة من غاز الأرجون تشغل حجما قدره 2 L عند درجة 100 ºC . احسب درجة الحرارة التي يصبح عندها حجم الغاز مساويا 3 L ، عند ثبوت الضغط :
V1 / T1 = V2 / T2
T1 = 100 +273 =373
2 / 373 = 3 / T2
T2=559.5 K
2 - يتمدد غاز حجمه 2L عند 100 kPa حتى ينخفض ضغطه إلى 20 kPa . احسب الحجم الجديد إذا ظلت درجة الحرارة ثابتة ؟
P1V1 = P2v2
2x 100 = 20xV2
V2 = 10 L
3 - إذا كان ضغط كمية معينة من غاز يساوي 100 kPa عند درجة C100 ( بفرض عدم تغيير الحجم ) احسب ضغط هذا الغاز عند C10 :
T2 = 10 +273 =283K
T1 = 100 +273 = 373 K
p1/T1=P2/T2
100/373=P2/283
P2= 75.87KPA
4 - إذا كان حجم بالون مملوء بالغاز يساوي 30 L عند درجة حرارة C40 وضغط 153 kPa ، فما هو حجم البالون عند الضغط ودرجة الحرارة القياسيين ( STP ) :
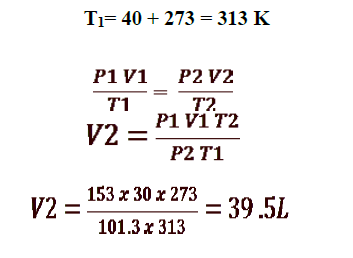
5 - يشغل غاز عند ضغط 155 kPa ودرجة حرارة C25 وعاء حجمه الأصلي 1L . يزداد ضغط الغاز إلى 605 kPa بفعل ارتفاع درجة الحرارة إلى C 125 ويتغير الحجم احسب الحجم الجديد ؟
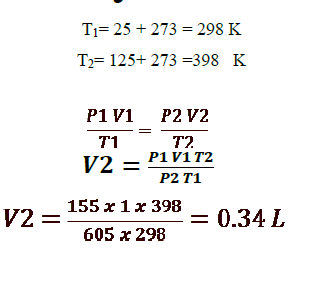
6 - عينة هواء حجمها 5L عند درجة حرارة C50وضغط 107 kPa . احسب الضغط الجديد عند ارتفاع درجة الحرارة إلى C102 وتمدد الحجم إلى 7L :
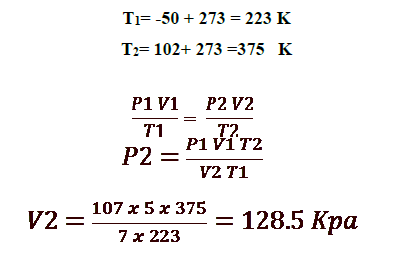
7 - اسطوانة مملوءة بغاز النيتروجين حجمها 20L عند ضغط kPa 2X10^4 ودرجة حرارة C28 فكم عدد مولات النيتروجين التي ستحتويها هذه الأسطوانة ( اعتبر غاز النيتروجين مثاليا ) ( R = 8.31 )
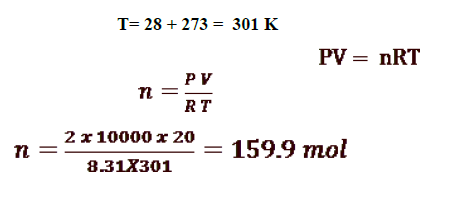
8 - تحتوي كرة على 685 L من غاز الهيليوم عند درجة حرارة 621 K وضغط kPa 1.89X10^ 3ما عدد مولات الهيليوم التي تحتوي عليها الكرة ( اعتبر الهيليوم غازا مثاليا ) :
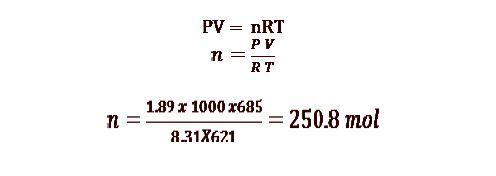
9 - ما الضغط الذي يسببه عدد مولات يساوي 0.45 mol من غاز مثالي محبوس في دورق حجمه 0.65 L عند درجة حرارة Co25 ؟
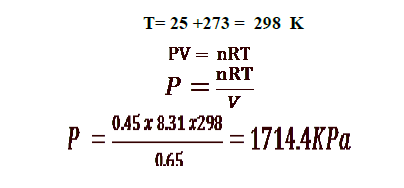
10 - حدد الحجم الذي يشغله 0.582 mol لغاز مثالي عند درجة حرارة C10 وضغط 81.8 kPa :
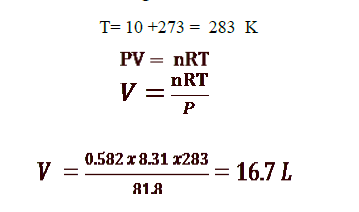
11 - إذا سُمِح لكمية من غاز الميثان ( CH4 ) كتلتها 28 g بالدخول إلى مخبار مفرغ سعته 2L عند درجة حرارة C35 ، احسب الضغط داخل المخبار ( اعتبر غاز الميثان غازا مثاليا ) ( = 16 M.wt CH4g/mol . )
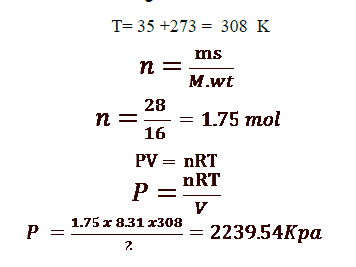
12 - عينة من غاز الأرجون تشغل حجما قدره 3.20 L عند درجة 127 ºC احسب درجة الحرارة السيليزية التي يصبح عندها حجم الغاز مساويا 1.56 L ، عند ثبوت الضغط :
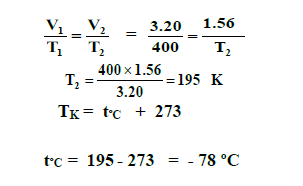
13 - احسب الضغط الكلي لخليط غازي يحتوي على أكسجين ونيتروجين وهيليوم إذا كانت الضغوط الجزئية للغازات كالتالي :

السؤال السابع :
ماذا يحدث في الحالات التالية مع كتابة التفسير :
1 - عند رفع درجة حرارة وعاء يحتوي على غاز ما؟
ينفجر جدار الوعاء ويتهشم بسبب زيادة متوسط الطاقة الحركية لجسيمات الغاز وتكون حركتها أسرع وعدد التصادمات بين جسيمات الغاز وجدار الوعاء أكثر وبطاقة أكبر مما يؤدي لزيادة الضغط فينفجر.
2 - عند الضغط على صمام عبوة الرذاذ ؟
تندفع المادة المستخدمة للخارج وذلك لأن العبوة تحتوي على غاز تحت ضغط عالي وعند الضغط على الصمام تحدث فتحة تعمل على نقل الغاز الدافع ذو الضغط العالي من داخل العبوة إلى المنطقة الخارجية ذات الضغط المنخفض.
3 - لحجم كمية معينة من الغاز عند ارتفاع درجة حرارته المطلقة عند ثبوت ضغط الغاز ؟
يزداد حجم الغاز بارتفاع درجة الحرارة المطلقة للغاز عند ثبوت الضغط.
4 - ملء إطارات السيارة بالهواء صيفاً ؟
عند ملء إطارات السيارة بالهواء صيفاً ومع ارتفاع درجة حرارة الجو وثبوت حجم الإطار فسوف ينفجر الإطار.
5 - ضغط داخل عبوة مزيل العرق عند تصغير حجمها إلى النصف ، حيث كانت سابقا 300 مل وأصبحت 150 مل ولكنها تحتوي على نفس الكمية ؟
يصبح الضغط داخل العبوة الجديدة الأصغر ضعف الضغط في العبوة القديمة وذلك لأن العلاقة عكسية بين الضغط
والحجم عند ثبوت درجة الحرارة .
6 - عند خفض درجة حرارة الإناء نفسه الحاوي على كمية معينة من الغاز إلى درجة ( 150 K ) فإن الضغط ينخفض ويصبح 50 kpa ؟
وذلك لأن هناك العلاقة طردية بين الضغط ودرجة الحرارة عند ثبوت الحجم حسب قانون تشارلز
7 - حجم بالون كان حجمه 4L عند درجة حرارة C 24 بعد تسخينه إلى درجة حرارة C 58 ؟
سيزداد حجم البالون حيث تشير النظرية الحركية إلى أن الحجم يزداد بزيادة درجة الحرارة عند ثبات الضغط ( قانون تشارلز )
8 - لضغط الغاز داخل الإطار المطاطي لدراجة عند نفخ الإطار مع ثبوت درجة حرارة الغاز وثبوت حجم الإطار :
عند نفخ الإطار المطاطي لدراجة نضيف مزيداً من الغاز أي تزيد عدد جسيمات الغاز وبالتالي تزيد اصطداماتها وبالتالي يزداد ضغط الغاز داخل الإطار
السؤال الأول :
اكتب بين القوسين الاسم أو المصطلح العلمي الذي تدل عليه كل من العبارات التالية :
1 - يمكن للذرات والأيونات والجزيئات أن تتفاعل وتُكون نواتج عندما يصطدم بعضها ببعض، بطاقة حركية كافية في الاتجاه الصحيح ( نظرية التصادم )
2 - أقل كمية من الطاقة التي تحتاج إليها الجسيمات لتتفاعل. ( طاقة التنشيط )
3 - جسيمات تظهر خلال التفاعل لا تكون من المواد المتفاعلة ولا الناتجة وتتكون لحظياً عند قمة حاجز التنشيط ( المركب المنشط )
4 - مادة تزيد من سرعة التفاعل من دون استهلاكها، إذ يمكن بعد توقف التفاعل استعادتها من المزيج المتفاعل من دون أن تتعرض لتغير كيميائي ( العامل الحفاز - المادة المحفزة )
5 - تفاعلات لا تستمر في اتجاه واحد حتى تكتمل بحيث لا تستهلك المواد المتفاعلة تماما لتكوين النواتج ، فالمواد الناتجة تتحد مع بعضها البعض لتعطي المواد المتفاعلة مرة أخرى تحت ظروف التجربة نفسها ( التفاعلات العكوسة )
6 - حالة النظام التي فيها تثبت تراكيز المواد المتفاعلة والمواد الناتجة و بالتالي تكون سرعة التفاعل الطردي مساوية لسرعة التفاعل العكسي طالما بقي النظام بعيداً عن أي مؤثر خارجي.
( حالة الاتزان الكيميائي الديناميكي )
7 - عند ثبات درجة الحرارة تتناسب سرعة التفاعل الكيميائي طردياً مع تركيزات المواد المتفاعلة كل مرفوع إلى أس يساوي عدد المولات أمام كل مادة في المعادلة الكيميائية الموزونة ( قانون فعل الكتلة )
8 - النسبة بين حاصل ضرب تركيزات المواد الناتجة من التفاعل إلى حاصل ضرب تركيزات المواد المتفاعلة كل مرفوع لأس يساوي عدد المولات في المعادلة الكيميائية الموزونة ( ثابت الاتزان )
9 - إذا حدث تغير في أحد العوامل التي تؤثر في نظام متزن ديناميكياً، يُعدل النظام نفسه إلى حالة اتزان جديدة، بحيث يبطل أو يقلل من تأثير هذا التغير ( مبدأ لوشاتلييه )
السؤال السابع:
ماذا يحدث في الحالات التالية مع ذكر السبب :
1 - لتوهج رقاقة خشبية عند وضعها في مخبار مملوء بغاز الأكسجين :
الحدث : يزداد توهج الرقاقة الخشبية
السبب : لزيادة تركيز غاز الأكسجين فتزداد عدد التصادمات فتزداد سرعة تفاعل الاحتراق
2 - لموضع الاتزان في النظام المتزن التالي عند زيادة الضغط :

الحدث : يقع ( يزاح ) موضع الاتزان في اتجاه تكوين المواد المتفاعلة أي في الاتجاه العكسي .
السبب : لأن زيادة الضغط تجعل موضع الاتزان يزاح ناحية المواد ذات عدد المولات الأقل طبقا لمبدأ لوشاتلييه أي ناحية المواد المتفاعلة اتجاه عكسي.
4 - في النظام المتزن التالي :
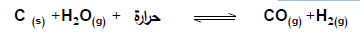
ماذا يحدث لموضع الاتزان وقيمة ثابت الاتزان عند زيادة درجة الحرارة :
الحدث : يزاح موضع الاتزان في الاتجاه الطردي أي في اتجاه تكوين المواد الناتجة . وتزداد قيمة ثابت الاتزان
السبب : لأن زيادة درجة الحرارة تجعل موضع الاتزان يزاح ناحية تقليلها طبقا لمبدأ لوشاتلييه أي ناحية المواد الناتجة اتجاه طردي وبالتالي يزداد تركيز النواتج على حساب نقص تركيز المتفاعلات فتزداد قيمة ثابت الاتزان
س 5 - ماذا يحدث لموضع الاتزان في النظام المتزن التالي :
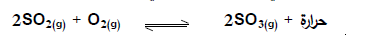
عند زيادة حجم الوعاء .
الحدث : عند زيادة حجم الوعاء يزاح موضع الاتزان في الاتجاه العكسي .
السبب : لأن زيادة حجم الوعاء ( خفض الضغط ) تجعل موضع الاتزان يزاح ناحية المواد ذات عدد المولات الأكبر طبقا لمبدأ لوشاتلييه أي ناحية المواد المتفاعلة اتجاه عكسي.
السؤال الثامن:
علل لما يأتي تعليلاً علمياً صحيحاً أذكر السبب :
1 - ارتفاع درجة حرارة المواد المتفاعلة يؤدي إلى سرعة تفاعلها :
بسبب زيادة عدد الجسيمات ذات الطاقة الحركية الكافية لتخطى حاجز طاقة التنشيط فتزداد عدد التصادمات الفعالة بين ذرات المواد المتفاعلة .
2 - يزداد توهج رقاقة خشبية مشتعلة عند إدخالها في مخبار مملوء بغاز الأكسجين :
زيادة تركيز الأكسجين يؤدي الى زيادة عدد التصادمات الفعالة بين ذرات المواد المتفاعلة مما يؤدي الى زيادة تفاعل الاحتراق