أوراق عمل محلولة كيمياء ثاني عشر علمي ف1 #أ. هاني نوح 2023-2024
| التاريخ | التوقيع | ملاحظات |
مواعيد الاختبارات القصيرة
| الاختبار | اليوم | التاريخ | الصفحات من | إلى |
فروض النظرية الحركية للغازات
السؤال الأول : اكمل جدول المقارنة التالي
| م | حالة المادة وجه المقارنة | المادة الصلبة | المادة السائلة | المادة الغازية |
| 1 | الشكل | ثابت | متغير بحسب شكل الإناء الذي يحتويه | متغير بحسب شكل الإناء الذي يحتويه |
| 2 | الحجم | ثابت | ثابت | متغير بحسب شكل الإناء الذي يحتويه |
| 3 | حركة الجسيمات | اهتزازية | انزلاقية | حرة عشوائية في خطوط مستقيمة |
| 4 | قوة التماسك | قوية | ضعيفة | ضعيفة جدا ( تعتبر غير موجودة ) |
السؤال الثاني : ضـع علامة ( √ )من العبارات التاليــة أمام الإجــابة الصحيحــة التـي تكمــل كلا من العبارات التالية
1 -جميع العبارات التالية صحيحة بالنسبة للنظرية الحركية للغاز ، عــدا واحدة منها ، وهي :
( ) تصـادم جسيمات الغـاز مرن
( ) حـركة جسيمات الغـاز عشوائية
( صح ) الضغـط على جدران الوعاء ناتج عن قوى التجاذب بين جسيمات الغـاز
( ) متـوسط طاقة حركة الجسيمات يتناسب طردياًمع درجة الحرارة المطلقة
2 -أي من الجمل التالية ال تتفــق مع فرضيـات النظرية الحركية للغازات :
( ) جسيمات الغاز صغيرة للغاية بالمقارنة مع المسافات التي تفصل بينها
( صح ) تفـقد جسيمات الغاز جزءا من طاقتها الكلية نتيجة التصادمات التي تحدثها
( ) لا تتجاذب جزيئات الغاز أو تتنافـر مع بعضها
( ) متوسط الطاقة الحركية لجسيمات الغاز عند درجة حرارة معينة ثابتة
3 -عند خفض درجة الحرارة المطلقة لغاز مثالي إلى النصف فإن طاقة حركة الجسيمات
( ) تزداد إلى الضعف
( صح ) تقل إلى النصف
( ) نقل إلى الثلث
( ) لا تتغير
4 -المتغير الذي يعبر عن متوسط الطاقة الحركية لجسيمات الغاز هو :
( ) عدد المولات
( ) الشغط
( صح ) درجة الحرارة
( ) الحجم
السؤال الثالث : املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 )تعتمد فكرة عمل الوسائد الهوائية على خاصية إنضغاط الغاز بسبب وجود الفراغ الحـر بين جسيماته .
2 )تمتاز الوسائد الهوائية في السيارات بقدرتها على امتصاص الطاقة الناتجة عن الصدمات أثناء الحوادث ذلك لأن الغازات قابلية للانضغاط
3 )متوسط الطاقة الحركية لجسيمات الغاز تتناسب طرديا مع درجة الحرارة المطلقة ( كلفــن )
4 )تفترض النظرية الحركية للغازات أن التصادمات بين جسيمات الغاز مرنة تماماً
السؤال الرابع : ماذا تتوقع أن يحدث في الحالات التالية ؟ وما السبب
1 -لعلبة الرذاذ عند تسخينها
| الحدث | السبب |
| انفجار علبة الرزاز | عند تسخين علبة الرزاز يزيد متوسط طاقة حركة جزيئات الغاز فتزيد التصادمات مع جدار العلبة فيزيد الضغط مما يؤدي إلى انفجارها |
السؤال : للوسائد الهوائية المستخدمة في السيارات عند حدوث اصطدامات ناتجة عن الحوادث
| الحدث | السبب |
| تنتفخ الوسادة وتنضغط | وجود فراغ بين جزيئات الغاز الموجود بها وبالتالي تكون قابلة لالنضغاط فتمتص الطاقة الناتجة عن التصادم عندما تقترب الجزيئات من بعضها البعض |
السؤال الخامس : علل ما يلي
1 -حجــوم جسيمات الغاز غير مهمة ( مهملـة ) بالنسبة لحجم الإنــاء الذي تشغله هذه الجسيمات
الجواب : لأن جسيمات الغاز صغير للغاية بالمقارنة مع المسافات التي تفصــل بينها
2 -الغازات لها القابلية للانضغاط وتتشكل بشكل الإنــاء الحاوي لها
الجواب : لأن جسيمات الغاز متباعدة عن بعضها بدرجة كبيرة ووجود فراغ بين جزيئاته مما يسمح لها بالأنضغاط
3 - تتحـرك جسيمات الغاز بحرية داخل الأوعية التي تشغلها ويأخذ شكل الوعاء الذي يحويه ويساوي حجمـه
أو الغازات تتميز بخاصية الانتشار .
الجواب :لعدم وجود قوى تجاذب أو تنافر بين جسيمات الغاز.
4 -الكمية الكلية للطاقة الحركية لجزيئات الغاز تظل ثابتة أثناء الاصطدام .
الجواب : لأن التصادم بين جسيمات الغاز يكون مرنا
5 - حدث جسيمات الغاز ضغطاً على جدار الوعاء الحاوي لها .
الجواب : نتيجة التصادمات المستمرة بين هذه الجسيمات وجدار الوعاء.
المتغيرات التي تصف سلوك الغاز
السؤال الاول : اكمل الجدول التالي
| م | المتغير | وحدة القياس |
| 1 | عدد المولات ( n ) | بالمول ( mol ) |
| 2 | الضغط ( P ) | بالكيلو باسكال ( kPa ) |
| 3 | الحجم ( V ) | (L)باللتر 1L = 1000ML = 1000CM وعليه فإن كل 1Ml=1cm |
| 4 | درجة الحرارة المطلقة ( T ) | بالكلفن ( K ) |
السؤال الثاني : املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 – العوامل المؤثرة في ضغط الغاز هي الحجم و درجة الحرارة المطلقة. و عدد المولات
2 - عند زيادة كمية الغاز في حجم معين عند ثبوت درجة الحرارة فإن ضغط الغاز يزداد
3 - إطار سيارة يحتوي mol 20 من الغاز ضغط الغاز بداخلة ( 200KPa ) زادت كمية الغاز بداخله إلى mol 25 فإن ضغط الغاز بداخله يصبح KPa...250
4 - ضغط الغاز داخل وعاء ذي حجم ثابت عند درجة حرارة ثابتة يقل كلما .قل عدد جسيمات الغاز
السؤال الثالث : ضع علامة( √ ) أو ( X ) أمام العبارة التالية
عند زيادة درجة حرارة كمية معينة من غاز من 20C إلى 40C فإن ضغط يزداد للضعف مع بقاء الحجم ثابت ( × )
السؤال الرابع :ضـع علامة ( √ ) أمام الإجابة الصحيحة التي تكمل كلا من العبارات التاليــة :
1 – جميع ما يلي يعمل على زيادة ضغط الغاز ما عدا
( ) ثبات حجم الغاز ودرجة الحرارة المطلقة له وزيادة عدد جسيماته
( )ثبات درجة الحرارة المطلقة للغاز وزيادة عدد جسيماته
( ) ثبات حجم الإناء ورفع درجة الحرارة المطلقة للغاز
( √ )خفض درجة الحرارة المطلقة للغاز وزيادة حجم الإناء
2 -عند ثبات درجة حرارة الغاز وحجمه، فإن مضاعفة عدد جسيمات الغاز تؤدي إلى :
( √ )مضاعفة الضغط
( ) زيادة الضغط أربعة أضعاف
( ) نقصان الضغط
( ) لا يتأثر الضغط
3 -جميع التغيرات التالية تؤدي إلى خفض ضغط الغاز، عـدا واحـداً منها وهي :
( ) زيادة حجم الوعاء وخفض درجة الحرارة
( ) تقليل عـدد مولات الغاز وخفض درجة الحرارة
( ) زيادة حجم الوعاء و تقليل عـدد مولات الغاز
( √ ) تقليل حجم الوعاء و زيادة درجة الحرارة
السؤال الخامس : ماذا تتوقع أن يحدث في الحالات التالية ؟ وما السبب
1- زيادة كمية من الغاز في إناء له حجم ثابت وعند درجة حرارة ثابتة ( بالنسبة للضغط )
| الحدث | السبب |
| يزداد الضغط | لأن بزيادة عدد الجسيمات يزداد عدد التصادمات مع جدار الوعاء فيزيد الضغط |
2- تبريد كمية من الغاز عند ثبات كمية الغاز وعدد المولات ( بالنسبة للضغط )
| الحدث | السبب |
| يقل الضغط | لأن خفض درجة الحرارة يعمل على نقص متوسط الطاقة الحركية لجسيمات الغاز وبالتالي يقل تصادم جسيمات الغاز بجدار الوعاء مما يؤدي إلى نقص الضغط . |
3- وضع أكياس البطاطا الجاهزة في أماكن تصلها الشمس
| الحدث | السبب |
| تنتفخ أكياس البطاطــا | لأن رفع درجة الحرارة يعمل على زيادة متوسط الطاقة الحركية لجسيمات الغاز بالتالي يزداد تصادم جسيمات الغاز بجدار الوعاء مما يؤدي إلى زيادة الضغط فتنفخ أكياس البطاطــا |
4- إذا سمح للهواء بالخروج من الإطار المطاطي للسيارة
| الحدث | السبب |
| ينبعج الإطار ( يقل ضغط الغاز بالإطار ) | لأن عدد جسيمات الغاز التي داخل الإطار تقل نتيجة خروج الهواء فتقل التصادمات فيقل الضغط داخل الإطار |
5-لحجم البالون عندما يتم إخراجه في طقس بارد
| الحدث | السبب |
| يقل الحجم | انخفاض درجة الحرارة يقلل من متوسط طاقة حركة الجسيمات فتقل المسافة بين جسيمات الغاز فيقل الحجم. |
الفصل الثاني : قوانين الغاز
أولاً : قانون بويل
السؤال الاول : أكتب المصطلح العلمي الدال على العبارات التالية
1 - يتناسب الحجم الذي تشغله كمية معينة من الغاز تناسباً عكسياً مع ضغط الغاز عند درجة حرارة ثابتة ( قانون بويل )
2 – احد قوانين الغازات يوضح العلاقة بين ضغط الغاز وحجمه عند ثبات درجة الحرارة وكمية الغاز .( قانون بويل )
السؤال الثاني :ضـع علامة ( √ ) أمام الإجابة الصحيحة التي تكمل من العبارات التاليــة :
1 – الرسم البياني المقابل يعبر عن احد قوانين الغازات وهو

( ) قانون تشارلز
( ) قانون جاي لوساك
( √ ) قانون بويل
( ) القانون الموحد للغازات
2 -وضعت كمية محددة من غاز الهيدروجين في إناء له نصف حجمه الأصلي عند ( C25 ) فإن ضغط الغاز
( ) لا يتغير
( ) يقل إلى الربع
( )يقل إلى النصف
( √ ) يزداد إلى الضعف
3 -إذا تغيّـر حجـم غاز من ( L 4 ) إلى ( L 1 ) مع ثبات درجة الحـرارة فأن الضغـط :
( ) لا يتغير
( ) يقل إلى الربع
( ) يزداد إلى الضعف
( √ ) يزداد إلى أربعة أمثال
4 -تأمل كل رسم مما يلي ثم اختر الإجابة المناسبة لكل سؤال مما يلي :
أ - الرسم المقابل يمثل أنبوبة شعرية بها زئبق يحبس كمية من الهواء فيكون ضغط الهواء المحبوس يساوي
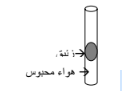
( ) الضغط الجوي
( √ )الضغط الجوي + ضغط عمود الزئبق
( ) الضغط الجوي - ضغط عمود الزئبق
( ) وزن عمود الزئبق
ب - من الرسم المقابل فإن ضغط الهواء المحبوس يساوي :
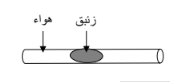
( √ )الضغط الجوي
( )الضغط الجوي + ضغط عمود الزئبق
( )الضغط الجوي - ضغط عمود الزئبق
( ) وزن عمود الزئبق
ج - من الرسم المقابل فإن ضغط الهواء المحبوس يساوي :
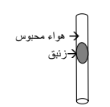
( )الضغط الجوي
( )الضغط الجوي + ضغط عمود الزئبق
( √ )الضغط الجوي - ضغط عمود الزئبق
( ) وزن عمود الزئبق
السؤال الثالث :املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1-عنـد زيادة حجم كمية معينة من غاز داخل إناء فإن (P1 ) تكون أكبر. من (P2 )لهذا الغاز عند ثبات بقية المتغيرات
2 -إذا كان (P1 ) أكبــر من (P2 ) لكمية من غاز داخل إناء ، فإن ( V2 ) تكـون أكبر. من ( V1 ) لهذا الغاز
3 -إذا كان حاصل ضـرب ( P1V1 ) لكمية معينة من غاز الهيدروجين يساوي ( L . kPa 3050 ) عند ثبوت درجة الحرارة ، فإذا تغـيّر حجـم هذه الكمية إلى ( L 50 ) فإن الضغـط الالزم لذلك ( P2 ) يساوي kPa .61
السؤال الرابع :حل المسائل التالية ؟
1 ) يحتوي منطاد على ( L 30 )من غاز الهيليوم ( He )عند ضغط (kpa 103 )على ارتفاع معين. ما حجم غاز الهيليوم عندما يصعد المنطاد إلى ارتفاع يصل الضغط فيه إلى (kpa 25 )فقط ؟ ( افترض أن درجة الحرارة تظل ثابتة )
الجواب :
P1.V1 = P2.V2
103 x 30 = 25 x V2
V2 =123.6 L
2 - يتغير ضغط ( L 5.2 ) من غاز التخدير من ( kPa 105 )إلى ( kPa 5.40 .)احسب الحجم الجديد عند ضغط (kPa 5.40 )مع افتراض ثبات درجة الحرارة.
الجواب :
P1.V1 = P2.V2
105O25 =40.5 × V2
V2 =6.48 L
3 -احسب حجم الغاز ( باللتر ) عند ضغط ( kpa 100 ،)إذا كان حجمه ( mL 1.5 kpa ) إلى ( 40.5 kpa ) احسب الحجم الجديد عند ضغط ( 40.5 ) مع افتراض ثبات درجة الحرارة
الجواب :
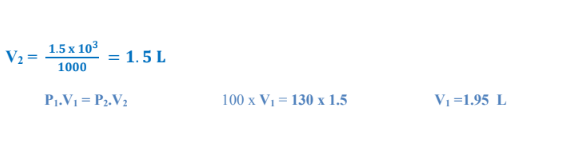
4 - كمية من غاز التخدير عند ضغط ( kPa 105 )حجمها ( L 5.2 ) عند زيادة الضغط عليها اصبح حجمها ( L 5.3 ) احسب الضغط المؤثر على الغاز عند الحجم الجديد مع افتراض ثبات درجة الحرارة.
الجواب :
P1.V1 = P2.V2
105 × 2.5 = P2 × 3.5
P2 =75 kpa
ثانيا : قانون تشارلز
السؤال الأول : اكتب المصطلح العلمي الدال على العبارات التالية
1 - يتناسب الحجم الذي تشغله كمية معينة من الغاز تناسباً طردياًمع درجة الحرارة المطلقة عند ثبات الضغط.( قانون تشارلز )
2 – احد قوانين الغازات يوضح العلاقة بين حجم الغاز ودرجة الحرارة المطلقة عند ثبات الضغط وكمية الغاز . ( قانون تشارلز )
3 - أقل درجة حرارة ممكنة التي تساوي عندها متوسط الطاقة الحركية لجسيمات الغاز "صفراً" نظرياً ( الصفر المطلق )
السؤال الثاني :ضـع علامة ( √ ) من العبارات التاليــة أمام الإجــابة الصحيحــة التـي تكمــل كـلا
1 -عنـد مضاعـفة درجة الحـرارة المطلقة على كمية من غاز مثالي تحت ضغـط ثابت فـإن حجمـها :
( ) لا يتغير
( ) يقل إلى الربع
( ) يقل إلى النصف
( √ ) يزداد إلى الضعف
2 -درجة الحرارة التي تساوي عندها متوسط الطاقة الحركية لجسيمات الغاز صفراً عند ثبوت الضغط هي :
( ) 100K
( √ ) -273 C
( ) -273 K
( ) 0 C
السؤال الثالث : املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 -عنـد رفع درجة حرارة كمية معينة من غاز داخل إناء فإن ( V1 ) تكون أصغر من ( V2 ) لهذا الغاز عند ثبوت الضغط
2 -إذا كان (T1 ) أكبــر من (T2 ) لكمية من غاز داخل إناء فإن ( V2 ) تكـون أصغر من ( V1 ) لهذا الغاز عند ثبوتP
3 -إذا كان نـاتج قسمة ( T1 / V1 ) لكمية معينة من غاز النيتروجين يساوي ( K / L 2.0 ) عند ثبوت الضغط ، فإذا تغـيّر حجـم هذه الكمية إلى ( L 120 ) فإن درجة الحرارة الالزمة لذلك ( T2 ) تساوي C327
السؤال الرابع : ( أ ) بإستخدام قواني الغازات عند إستخدام كمية معينة من الغاز أكمل الناقص :
| المعطيات و الثوابت | P2 = 2P1 عند ثبوت درجة الحرارة وكمية الغاز | T2 = 4T1 عند ثبوت الضغط وكمية الغاز |
| المطلوب | V2 = ½V1 | V1 =¼.V2 |
السؤال الخامس : العلاقة البيانية المقابلة لمثل أحد القواني التي تمثل سلوك الغاز المثالي
المطلوب :
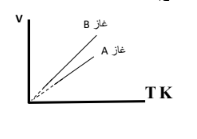
1 -الصيغة الرياضية للقانون.V1/T1 = V2/T2
2 -ماذا تستنتج من العلاقة البيانية يتناسب حجم الغاز طردياً مع درجة الحرارة المطلقة
3 -تتقاطع الخطوط البيانية التي تمثل العلاقة بين الحجم ودرجة الحرارة
عند درجة حرارة تساوي 0K. والتي تسمى.الصفر المطلق
السؤال السادس : حل المسائل التالية :
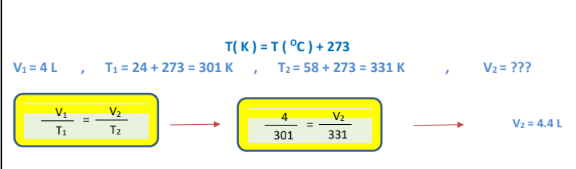
1 - نفخ بالون حجمه ( L 4 )عند درجة حرارة ( C 24 .)ثم سخن البالون إلى درجة حرارة C( 58 .)ما الحجم الجديد للبالون مع بقاء الضغط ثابتاً.
الجواب :
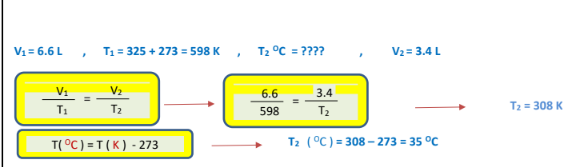
2 -تشغل عينة غاز ( L 6.6 )عند درجة حرارة ( C 325 .)احسب درجة الحرارة السيليزية عندما يصبح الحجم ( L 4.3 ) مع بقاء الضغط ثابتاً ؟
الجواب :
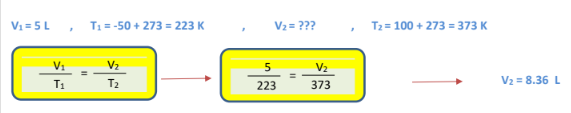
3 -تشغل عينة الهواء ( L 5 ) عند درجة حرارة ( C 50 ) - ما الحجم الذي ستشغله عند درجة حرارة C( 100 )مع بقاء الضغط ثابتاً؟
الجواب :
ثالثا : قانون جاي - لوساك
السؤال الأول: أجب عن السؤال التالي
الجدول التالي يوضح نتائج تجربة لدراسة العلاقة بيت ضغط الغاز ودرجة حرارته المطلقة عند ثبوت الحجم
| رقم التجربة | الضغط ( P ) كيلة باسكال | درجة الحرارة المطلقة(T) |
| 1 | 100 | 300 |
| 2 | 200 | 600 |
| 3 | 300 | 900 |
| 4 | 600 | ؟ |
المــطلــوب :
1 - ما القانون الذي تمثله النتائج السابقة قانون جاي لوساك
2 - ما هي العالقة بين الضغط ودرجة الحرارة المطلقة طردية
3 – احسب مقدار الثابت ( K )
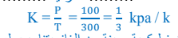
4 – اكتب نص القانون عند ثبات الحجم فإن ضغط كمية معينة من الغاز يتناسب طردياً مع درجة حرارتها
المطلقة.
5 - احسب درجة الحرارة السيليزية للغاز عنـد ضغــط (kPa 600 )
السؤال الثاني ضـع علامة ( √ ) أمام الإجــابة الصحيحــة التـي تكمــل كـلا من العبارات التاليــة :
1 -عنـد مضاعـفة درجة الحـرارة المطلقة على كمية من غاز مثالي تحت حجم ثابت ، فـإن ضغطها :
( ) لا يتغير
( ) يقل إلى الربع
( ) يقل إلى النصف
( √ ) يزداد إلى الضعف
2 -كمية من الهواء في إناء مغلق تحت ضغط (kPa 1.103 ) ودرجة حرارة ( K 300 ) فإذا سخنت إلى (K 600 ) وبفـرض ثبوت الحجـم فإن ضغطهـا :
( ) لا يتغير
( ) يقل إلى الربع
( ) يقل إلى النصف
( √ ) يزداد إلى الضعف
3 – الرسم البياني المقابل يعبر عن احد قوانين الغازات وهو
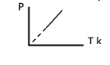
( ) قانون تشارلز
( √ ) قانون جاي لوساك
( ) قانون بويل
( ) القانون الموحد للغازات
السؤال الثالث :املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 -عنـد خفض درجة حرارة غاز داخل إناء فإن (P1 )تكون أكبر من (P2 )لهذا الغاز عند ثبوت الحجم
2 -إذا كان (1 T ) أكبــر من ( 2 T )لكمية من غاز داخل إناء فإن ( 2 P ) تكـون أصغر من ( P1 ) لهذا الغاز عند ثبوت V
3 -إذا كان نـاتج قسمة ( T1 / 1 P ) لكمية معينة من غاز الأكسجين يساوي ( K / kPa 2 ) عند ثبوت الحجـم ، فإذا تغـيّر ضغـط هذه الكمية إلى ( kPa 300 ) فإن درجة الحرارة الالزمة لذلك ( T2 ) تساوي C 123-
السؤال الرابع : حل االمسائل التالية ( حل في الصفحة المقابلة )
1 – إذا كان ضغط غاز ما ( kPa 58.2 )عند درجة حرارة ( K 539 ، )فكم يبلغ ضغطه عند درجة حرارة ( K 211 )مع
إبقاء الحجم ثابتا ؟
الجواب : P2=1KPa
2- ضغط الهواء في إطار سيارة هو ارتفع الضغط إلى ( kPa 198 . ) عند درجة حرارة ( 27 C ) وفي نهاية رحلة في يوم مشمس حار ، ارتفع الضغط إلى ( kPa 225 ) ما درجة حرارة الهواء داخل إطار السيارة. ( بفرض أن الحجم لم يتغير ) ؟
الجواب : T2=340.9 K
3- اضغط الغاز في وعاء مغلق ( kpa 300 ) عند درجة حرارة ( C 30) احسب الضغط إذا انخفضت درجة الحرارة إلى C ( -172)؟ ( يفرض أن الحجم لم يتغير )؟
الجواب : P2=100KPa
رابعا : القانون الموحد للغازات
السؤال الأول : املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 – الصيغة الرياضية للقانون الموحد للغازات هي
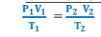
2 - القانون الموحد للغازات يبقي صالحاً فقط ما دامت عدد المولات ( كمية الغاز ) لم تتغير
3 -تبلغ درجة حرارة الغاز عند الظروف القياسية k 273 (0 C)
4 -الضغط القياسي لكمية معينة من غاز ما تساوي atm 1 = mmHg 760 = kpa 3.101
السؤال الثاني : ضـع علامة ( √ ) أمام الإجابة الصحيحة التي تكمل كلا من العبارات التاليــة :
1 -كمية معينة من غاز تشغل حجمـاً قدره ( L 5 ) تحت ضغط ( kPa 31.8 )ودرجة حـرارة ( K 300 ) عندما يصبح ضغطها ( kPa 62.16 ) ودرجة حرارتها ( K 600 ،)فإن حجمها :
( √ ) لا يتغير
( ) يقل إلى الربع
( ) يقل إلى النصف
( ) يزداد إلى النصف
2 -عينة من غاز ، إذا ضوعـف ضغطهـا و خفضت درجة حرارتها المطلقة إلى النصف ، فـإن حجمهـا
( ) يصبح أربع أمثال حجمها الأصلي
( ) يصبح ضعف حجمهـا الأصلـي
( ) يصبح نصف حجمهـا الأصلي
( √ ) يصبح ربـع حجمهـا الأصلي
3 -عينة من غاز ، إذا ضوعـفت درجة حرارتها المطلقة وخفض ضغطها إلى النصف ، فـإن حجمهـا :
( √ ) يصبح أربع أمثال حجمها الأصلي
( ) يصبح ضعف حجمهـا الأصلـي
( ) لا يتغير
( ) يقل إلى الربع
4 -الضغط القياسي لكمية معينة من غاز ما يساوي كل مما يأتي ما عدا
( ) 101.3 kPa
( ) 1atm
( √ ) 760 mHg
( ) 760 mmHg
السؤال الثالث :حل المسائل التالية ( حل في الصفحة االمقابلة )
1 -إذا كان حجم بالون مملوء بالغاز يساوي ( L 30 )عند درجة حرارة ( C40 )وضغط (kPa 153 ،)فما هو حجم البالون عند الضغط ودرجة الحرارة القياسيين ( STP )
الجواب : V 2 = 39.52 L
2 – يشغل غاز عند ضغط يساوي ( kPa 155 ) ودرجة حرارة ( C25 ) وعاء حجمه الأصلي ( L 1 . ) يزداد ضغط الغاز إلى ( kPa 605 ) بفعل ارتفاع درجة الحرارة إلى ( 0C 125 ) ويتغير الحجم . احسب الحجم الجديد.
الجواب :V 2 = 0.342 L
3 – عينة هواء حجمها ( L 5) عند درجة حرارة (C50 )- وعند ضغط (kPa 107 .)احسب الضغط الجديد عند ارتفاع درجة الحرارة إلى ( C 102 )وتمدد الحجم إلى ( L 7 .)
الجواب : P2 = 128.52 kpa
الدرس ( 2-2 ) قانون الغاز المثالي و النظرية الحركية
السؤال الأول : قارن بين الغاز المثالي والغاز الحقيقي
| الغاز المثالي | الغاز الحقيقي | |
| له وجود – افتراضي ليس له وجود | افتراضي ليس له وجود | له وجود |
| يمكن إسالته – لا يمكن اسالته | لايمكن اسالته | يمكن إسالته |
يتبع قوانين الغازات ( عند جميع الظروف – عند ظروف معينة ) | يتبع قوانين الغازات عند جميع الظروف | يتبع قوانين الغازات عند ظروف معينة |
السؤال الثاني : املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1 - يتناسب عدد مولات الغاز تناسباً. طردياً مع حجم العاز عند ثبات الضغط ودرجة الحرارة .
2 - الحجم الذي يشغله المول الواحد من الغازات المختلفة عند الظروف القياسية من الضغط و درجة
الحرارة يساوي L 22.4
السؤال الثالث : حل المسائل التالية
1 -إذا قام عامل في شركة تعبئة الغاز بملء اسطوانة حجمها ( L 20 )بغاز النيتروجين ( N2 )إلى أن يصبح ضغط الغاز ( 2×10*4 Kpa ) عند درجة 28 فكم عدد مولات ( N2 ) التي ستحتويها هذه الاسطوانة ؟ ( اعتبر غاز N2غازا مثاليا )
الجواب :
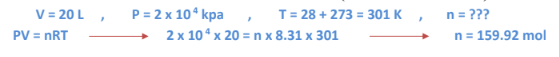
2 -ما الضغط الذي يمارسه عدد مولات يساوي ( mol 45.0 )من غاز مثالي محبوس في دورق حجمه ( 0.65 L ) عند درجة حرارة 25 ؟
الجواب :

3 – سعة رئة طفل ( L 18.2 .)ما هي كتلة الهواء الذي تتسع له رئة هذا الطفل عند ضغط ( kpa 102 )ودرجة حرارة الجسم المعتادة أي ( C 37) ؟ الهواء خليط، لكن يمكن أن تفترض أن كتلته المولية المتوسطة قدرها )mol/g 29[.) الحل : g 5.2 هواء
الجواب :
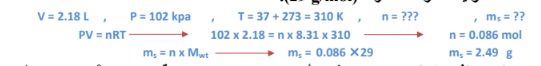
4 –ما الحجم الذي يشغله ( 12g )من غاز الأكسجين (( g ))O2 ) عند درجة حرارة (C 25 ) وضغط .( 52.7 Kpa ؟ 32 g/mol = .) Mwt.(O2(g))
الجواب :

الدرس ( 2-3 :) الجسيمات الغازية : مخاليطها وحركتها
السؤال الأول :اكتب المصطلح العلمي الدال على العبارات التالية
1 - الحجوم المتساوية من الغازات المختلفة عند درجة الحرارة والضغط نفسيهما تحتوي على أعداد متساوية من الجسيمات ( فرضية أفوجادرو )
2 - الحجم الذي يشغله المول الواحد من الغازات المختلفة عند الظروف القياسية من الضغط و درجة الحرارة يساوي ( 22.4 L ) ( الحجم المولي )
السؤال الثاني : -ضـع علامة ( √ )من العبارات التاليــة أمام الإجــابة الصحيحــة التـي تكمــل كـلا من العبارات التالية
1 -اذا علمت أن ( 16 = O , 12 = C ) فإن الحجم الذي تشغله كتلة قدرها ( g 11 ) من غاز ثاني أكسيد الكربون ( CO2 ) في الظروف القياسية يساوي.
(11.2 L )
( 44.8 L )
( 22.4 L )
( 5.6 L ) √
2 -الحجم الذي يشغله ( g 10 ) من النيون ( 20 = Ne ) في الظروف القياسية يساوي:
22.4 L
L 30
11.2 L √
10 L
3 -ثلاث بالونات يرمز لها بالرموز ( a , b , c ) يحتوي البالون ( a ) على (g 4.0 ) من الهيدروجين ، ويحتوي البالون( b ) على ( g 64.0 ) من الأكسجين ، ويحتوي البالون ( c ) على ( g 56.0 ) من النيتروجين ، فإذا تعرضت البالونات الثلاث لنفس الظروف من الضغط ودرجة الحرارة ، ( 14 = N , 16 = O , 1 = H، ) فإن :
( √ ) حجوم البالونات الثالثة تكون متساوية
( ) حجم البالون ( a ) اكبر من حجم البالون ( b.)
( ) حجم البالون ( b ) اكبر من حجم البالون ( c .)
( ) حجم البالون ( c ) اكبر من حجم البالون ( a .)
4 -عـدد الجسيمات الموجـودة في ( L 2 ) من غـاز الهيدروجين .....................عـدد الجسيمات الموجـودة في ( L 2 ) من غـاز النيتروجين عنـد درجة الحرارة والضغط نفسيهما .
( ) أكبر من
( ) أقل من
( √ ) يساوي
( ) لا توجد إجابة صحيحة
السؤال الثالث :حل المسائل التالية
1 - احسب الحجم ( باللتر ) الذي يشغله ( mol 75.0. 0 )من غاز ما عند الظروف القياسية من الضغط ودرجة الحرارة ( STP . )
الجواب :
V = n x 22.4
V = 0.75 x 22.4
V = 16.8 L
2 - ما عدد جزيئات غاز الأكسجين الموجودة في ( L 36.3 )من غاز الأكسجين عند الظروف القياسية من الضغط ودرجة الحرارة؟
الجواب :

3 – ما الحجم الذي يشغله ( 4.02×10*22 جزيء ) من غاز الهيليوم عند الظروف القياسية؟
الجواب :
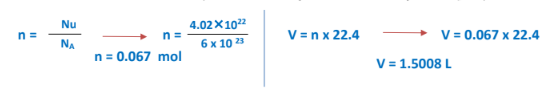
4 -احسب حجم وكتلة ( mol 25.0 ) من غاز الهيدروجين ( mol/g 2 = H2 ) عند الظروف القياسية من الضغط ودرجة الحرارة (STP) 31.8 = R
الجواب :
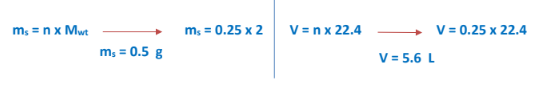
5 - احسب كتلة وعدد جزيئات غاز الميثان التي توجد في وعاء حجمه ( L 72.6 ) عند درجة حرارة ( 27 ) وضغط (C R = 8.31 , CH4 = 16 g/mol ( 202.6 kPA
الجواب :
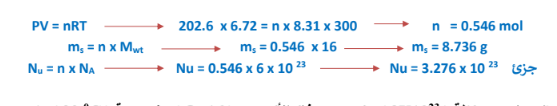
6 -ما حجم وكتلة ( 3×10*23 ) جزيء من غاز الأكسجين ( 16=O ) عند درجة (20 ) وتحت ضغط ( R = 8.31( 303.9 kPa
الجواب :

7 - ما أقصى درجة حرارة يمكن عندها تخزين أسطوانة تحتوي على ( g 320 ) من غاز الأكسجين ( 16 = O ) حجمها ( L 20 ) إذا كان أقصى ضغط تتحمله هذه الأسطوانة ( kPa 1350 ) 31.8 = R
الجواب :
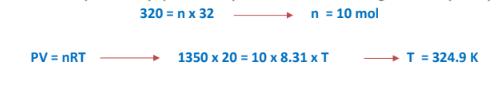
قانون دالتون للضغوط الجزئية
السؤال الأول : اكتب المصطلح العلمي الدال على العبارات التالية
1 - الضغط الناتج عن أحد مكونات خليط غازي إذا شغل حجماًمساوياً لحجم الخليط عند درجة الحرارة نفسها ( الضغط الجزئي )
2 - عند ثبات الحجم ودرجة الحرارة، يكون الضغط الكلي لخليط من عدة غازات لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزئية للغازات المكونة للخليط.( قانون دالتون للضغوط الجزئية )
السؤال الثاني : علل ملا يأتي
يجب أن يحمل متسلقو الجبال والطيارون الذين يبلغون ارتفاعات عالية امدادات أكسجين
الجواب : لأن الضغط الجوي يتناقص كلما ارتفعنا لأعلى و بالتالي يقل الضغط الجزئي للأكسجين فيصبح غير كاف لتنفس لإنسان
السؤال الثالث :املأ الفراغات في الجمل والعبارات التالية مبا يناسبها علميا
1- إناء حجمه (5.6 L ) وضع فيه ( 0.5 mol ) من غاز الهيدروجين ( 0.2 mol) من غاز النيتروجين فيكون حجم غاز الهيدروجين فقط في الإناء يساوي L :
الجواب : 5.6
2- إناء حجمه (5.6 L ) وضع فيه ( 0.5 mol ) من غاز الهيدروجين ( 0.2 mol) من غاز النيتروجين فيكون حجم المخلوط في هذا الإناء يساوي L :
الجواب : 5.6
3- إناء حجمه ( 2L ) به غاز هيليوم تحت ضغط ( 81 Kpa ) وإناء آخر حجمه ( 1.2 L) به غاز الاكجسين تحت ضغط ( kPa 162 ) فإذا تم نقل الغازين إلى إناء جديد حجمه ( L 4 ) فإن حجم غاز الهيليوم يساوي L 4وحجم غاز الاكسجين يساوي L4
4- وصل غناء حجمه ( L 2 ) به غاز النيون ضغطه ( kPa 04.81 ) مع إناء حجمه ( L4 ) به غاز الارجون ضغطه ( kPa 78.60 ) فإذا ظلت درجة الحرارة ثابتة مع إهمال حجم الوصلة بينهما فإن حجم النيون يساوي 6L وحجم غاز الارجون يساوي L6
5- إذا كان الضغط الجزئي لغاز النيون ( kPa 100 ) و الضغط الكلي في وعاء يحتوي على خليط من النيون و الهيليوم يساوي ( kPa 300 ) فإن الضغط الجزئي لغاز الهيليوم يساوي (kPa200 )
السؤال الرابع : حل المسائل التالية
1 - احسب الضغط الكلي لخليط غازي يحتوي على أكسجين ونيتروجين وهيليوم إذا كانت الضغوط الجزئية للغازات كالتالي (( PHe = 26.7 kPa , PN2 = 46.7 kPa , PO2 = 20 kPa ))
الجواب :
PT = P1 + P2 + P3
PT = 26.7 + 46.7 + 20
PT = 93.4 kpa
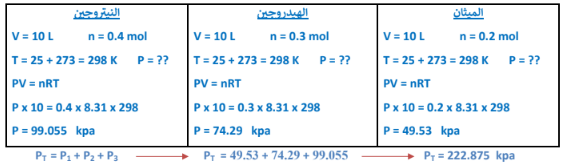
2 -قنينة حجمهــا ( L 10 ) تحتوي على ( mol 2.0 )من غاز الميثان ( CH4 ) مع ( mol 3.0 ) من غاز الهيدروجين مع )
( o ) mol 4.0 من غاز النيتروجين عند درجة حرارة (C25 )
المطلوب حساب الضغط الكلي للخليط داخل القنينة علماً بأن : ( K mol/ L . kPa 31.8 = R)
الجواب :
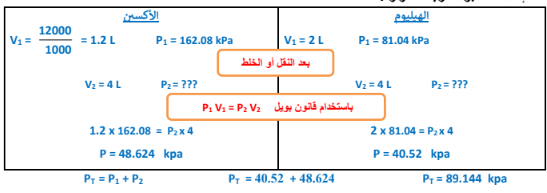
3 -إناء حجمه( L 2 ) به غاز هيليوم تحت ضغط ( kPa 04.81 ، ) وآخر حجمه ( mL 1200 ) به غاز أكسجين تحت ضغط ( kPa 08.162 ، ) فإذا تم نقل الغازين إلى إناء جديد حجمه L 4 ، ) فاحسب الضغط داخل هذا الإناء عند ثبوت درجة الحرارة.
الجواب :
4 - إناء حجمه ( L 2 ) به غاز هيدروجين تحت ضغط ( kPa 52.40 ، ) و آخر حجمه ( L 6 ) به غاز نيتروجين تحت ضغط ( kPa 78.60 ، ) فإذا ظلت درجة حرارتهما ثابتة ومتساوية وتم توصيل الإناءين معا ، فاحسب الضغط الكلي للغازين في الإناء الجديد ) مع إهمال حجم التوصيلة بينهما
الجواب :
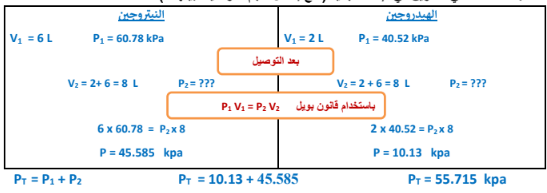
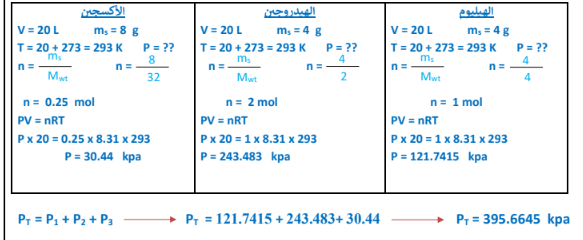
5 -احسب الضغط الكلي لمخلوط مكون من ( g 4 ) هيليوم ، ( g 4 ) هيدروجين ، ( g 8 ) أكسجين موضوع في إناء حجمه ( 20L ) عند ( 20 C ) علما بأن ( R = 8.31 ، He = 4 ، H = 1 ، O = 16 )
الجواب :
الوحدة الثانية : سرعة التفاعل الكيميائي و الاتزان الكيميائي
السؤال الأول : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1 -كمية المتفاعلات التي يحدث لها تغـــير خــلال وحـــدة الزمــن ( سرعة التفاعل الكيميائي )
2 -يمكـن للذرات و الأيونات والجزيئات أن تتفاعـل وتكـون نـواتج عنـدما يصطدم بعضها ببعض ، بطاقة حركية كافيـة في الاتجاه الصحيح ( نظرية التصادم )
3 -أقل كمية من الطاقة التي تحتاج إليها الجسيمات لتتفاعل ( طاقة التنشيط )
4 -ترتيب مؤقت للجسيمات ( للذرات ) عند قمة حـاجز طاقة التنشيط وقـد يتفكك مرة ثانية ليعطي المتفاعلات أو يستمر في الاتجاه الصحيح لتكوين النواتج عندما يمتلك الطاقة الكافية ( المركب المنشط )
السؤال الثاني :ضـع علامة ( √ )من العبارات أمام الإجــابة الصحيحــة التـي تكمــل كلا العبارات التاليــة :
1 -إحـدى العبارات التالية لا تعــّبر عن سرعة التفاعل الكيميائي :
( ) كمية المتفاعلات التي يحدث لها تغـــير خلال وحـــدة الزمــن
( ) مقدار التغير في عــدد المولات خـلال وحدة الزمن
( ) كمية النواتج من التفاعل في وحـدة الزمـن
( √ ) كمية المادة المحفزة اللازمة لبدء التفاعل في وحدة الزمن
2 -وفـــق نظريــة التصــادم :
( ) كل تصادم بين جسيمات المواد المتفاعلة يؤدي إلى تفاعـل
( √ ) التصادمات بين جسيمات المواد المتفاعلة هي الشرط اللازم لحدوث التفاعل لكنه غيـر كــاف
( ) التصادمات بين الجسيمات التي لها طاقة أقل من طاقة التنشيط تستمر في الاتجاه الصحيح نحو النواتج
( ) التصادمات بين الجسيمات التي لها طاقة أكبر من طاقة التنشيط لا تتفاعل
3 -جميع العبــارات التالية صحيحــة للمركب المنشط عــدا واحـــدة منها ، وهى :
( ) لا يعتبر من المواد المتفاعلة أو المواد الناتجة
( ) يسمى أحياناً بالحالة الانتقالية
( √ ) لا يمكن أن يتفكك مرة أخرى ليعطي المواد المتفاعلة
( ) عبارة عن جسيمات تتكون لحظياً عند قمة حاجز التنشيط
السؤال الثالث : علل لما يأتي ؟
1 - لا ينتج عن كل اصطدام تفاعل . أو ** ال يكفي تصادم جسيمات المادة مع بعضها بعضاً لكي يحدث التفاعل .
الجواب : لأنه وفق نظرية التصادم لابد ان تمتلك الجسيمات طاقة حركية للتفاعل و الاندفاع بالاتجاه الصحيح لكي يحدث التصادم المؤثر
2 - المركب المنشط غير مستقر بدرجة كبيرة جداً
الجواب : لأنه ما غن يتكون حتى يتفك مرة أخرى ليعطي المواد المتفاعلة أو يستمر ليكون النواتج إذا توفرت طاقة كافيى و توجه صحيح للذرات
3- العوامل التي تؤثر يف سرعة التفاعل الكيميائي
الجواب : درجة الحرارة ، التركيز ، حجم الجسيمات ، المواد المحفزة
السؤال الأول : اكتب االسم أو المصطلح العلمي لكل ممــا يلـــي :
1 -مادة تزيد سرعة التفاعل من دون استهلاكها إذ يمكن استعادتها بمجرد توقف التفاعل من دون استهلاكها (المادة المحفزة )
2 -المواد المحفزة الحيوية التي تزيد من سرعة التفاعلات البيولوجية ( الإنزيمات )
3 -المادة التي تعارض تأثير المادة المحفزة وتضعف تأثيرها مما يؤدي إلى بطء التفاعل أو انعدامه ( المادة المانعة للتفاعل )
السؤال الثاني :ضـع علامة ( √ ) أمام الإجــابة الصحيحــة التـي تكمــل كـلا من العبارات التاليــة :
1 -ارتفاع درجة الحرارة في جميع التفاعلات الكيميائية يؤدي إلى زيادة سرعة التفاعل نتيجة زيادة :
( ) حجم الغازات لثبات ضغطها
( √ ) احتمالية التصادمات الفعالة بين الجسيمات المتفاعلة
( ) طاقة حاجز التنشيط اللازم لبدء التفاعل
( ) تركيز المواد المتفاعلة
2 -إحــدى العوامل التالية غيــر مفضــل لــزيادة سرعة التفاعل :
( √ ) زيادة درجة الحرارة
( ) إضافة مادة محفزة
( ) تقليل حجم الجسيمات المتفاعلة
( ) زيادة تركيز المواد المتفاعلة
3 -جميع الطرق التالية تعمل على نشاط مادة صلبة متفاعلة عــدا واحدة منها ، وهى :
( ) إذابتها في مذيب مناسب
( √ ) تبريد هذه المادة
( ) زيادة درجة حرارتها
( ) طحنها وتحويلها إلى مسحوق ناعم
4 -يمكن تقليل سرعه التفاعل الكيميائي بـ:
( ) زيادة عدد جسيمات المتفاعلات
( √ ) إضافه ماده مانعه للتفاعل
( ) زيادة مساحه سطح المتفاعلات
( ) رفع درجه الحرارة
5 -تعمــل المادة المحفــزة للتفاعــل على :
( ) تقليل كمية النواتج في فترة زمنية معينة
( ) زيادة حاجز طاقة التنشيط
( √ ) خفض حاجز طاقة التنشيط
( ) بطء التفاعلات أو انعدامها
6 -جميع ما يلي يعمل على زيادة سرعة التفاعل عدا واحدة منها ، وهي :
( ) رفع درجة الحرارة
( ) زيادة تركيز المواد المتفاعلة
( √ ) زيادة حجم جسيمات المواد المتفاعلة
( ) زيادة عدد جسيمات المواد المتفاعلة
السؤال الثالث :أكمــل العبــارات التاليــة بما يناسبها علميا
1 -تتوهج رقائق خشبية في الهواء بدرجة أقل من توهجها في مخبار مملوء بالأكسجين
3 -كلما صغر حجم جسيمات المواد المتفاعلة زادت مساحة السطح لكتلة معينة وبالتال تزيد سرعة التفاعل
4 -يمكن زيادة مساحة السطح للمتفاعلات عن طريق إذابة المادة الصلبة لعمل محلول منها أو طحنها وتحويلها إلى مسحوق ناعم
5 -كتل الفحم الكبيرة أقل نشاط من غبــار الفحــم. المعلق و المتناثر في الهواء
8 -تفاعل كلوريد الصوديوم الصلب مع نيترات الفضة الصلب أقل سرعة من تفاعل محلول كلوريد الصوديوم مع محلول نيترات الفضة
9 -المادة المحفزة تعمل على خفض حاجز طاقة التنشيط وبالتالي تزداد كمية النواتج
10 -المادة التي لا تظهر في معادلة التفاعل الكيميائي ضمن المواد المتفاعلة أو الناتجة وتعمل على خفض حاجز طاقة التنشيط تسمى المادة المحفزة
السؤال الرابع : علل ملا يأتي ؟؟
1 -يرتدي عامل اللحام نظارة خاصة عند قيامه بعملية لحام المعادن باستخدام غاز الايثاين والأكسجين النقي.
الجواب : لأن تفاعل غاز الإيثاين مع غاز الاكسجين النقي ، يعطي لهب تصل درجة حرارته إلى أكثر من 3000 C وهي كافية للحام الفلزات بعضها ببعض وفي بعض الأحيان لقطع فلز ما .
2 -ارتفاع درجة حرارة المواد المتفاعلة يؤدي إلى زيادة سرعة تفاعلها
الجواب :لأن ارتفاع درجة الحرارة يعمل على زيادة طاقة حركة الجسيمات حتى تصبح كافية لتخطي حاجز طاقة
التنشيط فتتفاعل عند اصطدامها.
3 -زيادة تركيز المواد المتفاعلة يؤدي إلى زيادة سرعة تفاعلها .
الجواب : لأن بزيادة تركيز المتفاعالت يزداد عدد الجسيمات في حجم محدد وبالتالي تزيد عدد التصادمات، فتزيد سرعة التفاعل.
4- سرعة تفاعل الكربون ( الفحم ) مع الأكسجين في درجة حرارة الغرفة تساوي صفراً
الجواب :لأنه عند درجة حرارة الغرفة، لا تكون تصادمات جزيئات الأكسجين والكربون فعالة ونشطة بدرجة كافية لكسر روابط الأكسجين والكربون
5 -منع التدخين في المناطق التي تستخدم فيها الأنابيب المعبأة بالأكسجين
الجواب :لأن الحرارة الناتجة عن التدخين بالقرب من الأكسجين تؤدي إلى عملية احتراق سريعة لزيادة تركيز الأكسجين وزيادة التصادمات .
6 -تفاعل محلول حمض الهيدروكلوريك مع برادة الحديد أسرع من تفاعله مع قطعة من الحديد
الجواب :بسبب صغر حجم جسيمات برادة الحديد وبالتالي زيادة مساحة سطحها المعرض للتفاعل وبالتالي زيادة معدل التصادمات فتزيد سرعة التفاعل
7 -يفضل طحن المادة الصلبة وتحويلها إلى مسحوق ناعم اثناء التفاعل الكيميائي
الجواب :لأن طحن المادة يؤدي إلى صغر حجم الجسيمات وبالتالي زيادة مساحة سطحها المعرض للتفاعل وبالتالي زيادة معدل التصادمات فتزيد سرعة التفاعل
السؤال الخامس: ماذا تتوقع أن يحدث في الحالات التالية ؟ وما السبب
1 - لرقاقة الخشب المشتعلة عند إدخالها في مخبار مملوء بالأكسجين
| الحدث | السبب |
| يزداد توهج الرقائق الخشبية | لأن تركيز غاز الأكسجين في المخبار يكون أعلى من تركيزه في الهواء الجوي لذلك تزداد احتمالية التصادمات بين الأكسجين والمادة المشتعلة مما يزيد من سرعة التفاعل فيزداد التوهج . |
2 -لسرعة التفاعل الكيميائي عند إضافة مادة محفزة إليه .
| الحدث | السبب |
| تزداد سرعة التفاعل | إيجاد آلية جديدة تعمل على خفض حاجز طاقة التنشيط وبالتالي تزداد سرعة التفاعل |
3 - لغبار الفحم المعلق والمتناثر داخل مناجم الفحم عند اشتعاله
| الحدث | السبب |
| حدوث انفجار | لأن غبار الفحم المعلق والمتناثر في الهواء يكون نشط للغاية بسبب صغر حجم جسيماته وبالتالي زيادة مساحة سطحه وزيادة معدل التصادمات مما يجعله قابلا لالحتراق بسرعة وبالتالي حدوث انفجار. |
الدرس ( 1 -2 ) التفاعلات العكوسة والاتزان الكيميائي
السؤال الأول : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1 - هي تفاعلات تحدث في اتجاه واحد حتى تكتمل بحيث لا تستطيع المواد الناتجة من التفاعل أن تتحد بعضها مع بعض لتكوين المواد المتفاعلة مرة أخرى . ( التفاعلات غير بالعكوسة )
2 - هي تفاعلات لا تستمر في اتجاه واحد حتى تكتمل، بحيث لا تستهلك المواد المتفاعلة تماماً لتكوين النواتج ، فالمواد الناتجة تتحد مع بعضها البعض مرة ثانية لتعطي المواد المتفاعلة مرة أخرى تحت ظروف التجربة نفسها ( التفاعلات العكوسة )
3 - هي التفاعلات العكوسة التي تكون فيها جميع المواد المتفاعلة والناتجة من التفاعل في حالة واحدة من حالات المادة . ( التفاعلات العكوسة المتجانسة )
4 - التفاعلات العكوسة التي تكون فيها المواد المتفاعلة والناتجة من التفاعل في أكثر من حالة فيزيائية ( التفاعلات العكوسة الغير متجانسة )
السؤال الثاني : أكمل جدول المقارنة التالي
| خصائص التفاعل الغير عكوس | خصائص التفاعل العكوس |
1 – تفاعل تام . 2- التفاعل يكتمل حتى نهايته 3 – لا تستطيع المواد الناتجة أن تتحد مع بعضها لتكوين المواد المتفاعلة | 1 – تفاعل غير تام 2- التفاعل لا يكتمل حتى نهايته 3 – تستطيع المواد الناتجة أن تتحد مع بعضها لتكوين المواد المتفاعلة . 5- تركيز المتفاعلات و النواتج يظل ثابت عند الاتزان |
السؤال الثالث : علل؟ تفاعل محلول ( AgNO3 ) مع محلول ( NaCl )من التفاعلات الغير عكوسة
الجواب : لأنه يحدث في اتجاه حتى يكتمل بحيث لا تستطيع المواد الناتجة من التفاعل أن تتحد بعضها مع بعض لتكوين المواد المتفاعلة مرة أخرى".
السؤال الرابع اكمل ؟ تنقسم التفاعلات العكوسة حسب ( الحالة الفيزيائية ) للمواد المتفاعلة والمواد الناتجة إلى
الجواب : تفاعلات عكوسة متجانسة ، تفاعلات عكوسة غير متجانسة
السؤال الخامس : وضح في القوسين المقابلين ما إذا كان عكوس متجانس أن عكوس غير متجانس ؟
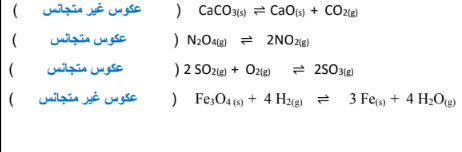
الاتزان الكيميائي الديناميكي
السؤال الأول : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1 - هي حالة النظام التي فيها تثبت تركيزات المواد المتفاعلة والمواد الناتجة وبالتالي تكون سرعة التفاعل الطردي مساوية لسرعة التفاعل العكسي طالما بقي النظام بعيدا عن أي مؤثر خارجي ( الاتزان الكيميائي الديناميكي )
2 - التركيزات النسبية للمواد المتفاعلة والمواد الناتجة عند الاتزان. ( موضع الاتزان )
3 - عند ثبات درجة الحرارة، تتناسب سرعة التفاعل الكيميائي طردياً مع تركيزات المواد المتفاعلة كل مرفوع إلى أس يساوي عدد المولات أمام كل مادة في المعادلة الكيميائية الموزونة ( قانون فعل الكتلة )
4 - النسبة بين حاصل ضرب تركيز المواد الناتجة من التفاعل ( النواتج ) إلى حاصل ضرب تركيز المواد المتفاعلة ( ثابت الاتزان Keq )
السؤال الثاني : أكمل جدول المقارنة التالي والذي يوضح ما تدل عليه قيمة ( Keq )
| قيمة ( Keq ) أكبر من واحد | قيمة(Keq ) أصغر من واحد | |
| تركيز المتفاعلات و النواتج | تركيز النواتج أكبر من تركيز المتفاعلات | تركيز النواتج أقل من تركيز المتفاعلات |
| اتجاه موضع الاتزان | يزاح بالاتجاه الطردي | يزاح بالاتجاه العكسي |
| استهلاك المواد الناتجة | اقل | أكبر |
| التفاعل المفضل | الطردي | العكسي |
السؤال الثالث :علل ملا يأتي ؟
تعبير ثابت الاتزان ( Keq ) لا يشمل المواد الصلبة و لايشمل الماء في الحالة السائلة في المتفاعلات
الجواب : لأن تركيزها ثابت و يساوي الواحد
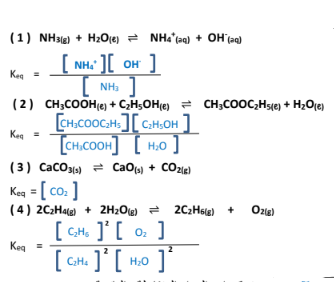
السؤال الرابع : اكتب تعبري ثابت الاتزان للمعادلات التالية
السؤال : أكمــل العبــارات التاليــة مبا يناسبها علميا
1 -يصل التفاعل الكيميائي إلى حالة الاتزان عندما تثبت تركيزات المواد المتفاعلة والناتجة
2 -عندما يصل التفاعل الكيميائي إلى حالة الاتزان الكيميائي الديناميكي فإن سرعة التفاعل الطردي تساوي سرعة التفاعل العكسي

السؤال : ضع علامة ( صح ) أمام الإجابة الصحيحة التي تكمل كلا من العبارات التالية
1 -في النظام المتزن التالي : (g(Cl2) + g(PCl3) ⇌ g(PCl5 تتناسب سرعة التفاعل الطردي تناسباً :
( ) طرديا مع PCl3
( √ ) عكسياً مع ( PCL3 ) Cl2 )
( ) عكسياً مع ( PCl5 )
( ) عكسياً مع (PCl5 ) Cl2

مسائل على حساب ثابت الاتـــزان
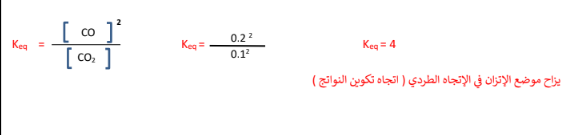
1 -في النظام المتزن التالي : (g(CO 2) s(C) + g(CO2 وجــد أن تركيز كل من غازي ( CO2 , CO ) عندالاتزان يساوي ( M ( 1.0 , 2.0 على الترتيب ، احسب قيمة ثابت الاتزان ( Keq ) لهذا النظام ، وبناء على إجابتك ، أين يزاح موضع الاتزان
الجواب :
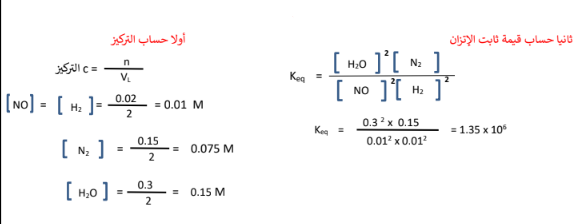
2 -النظام المتزن التالي حدث في وعاء سعته ( L 2) : ( g(2H2O) + g(N2 2H2) + g (2NO وعنـد الاتزان وجـد أن المخلوط يحتوي على ( 0.02 mol ) من غازي ( NO , H2 ) ، (Mol 0.15 ) من غاز ( N2 ) ( 0.3 MOL ) من بخار الماء احسب قيمة ثابت الاتزان (Keq ) لهذا النظام ؟
الجواب :
3-

4-
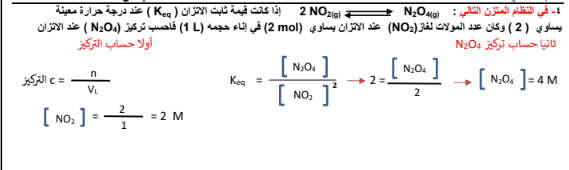

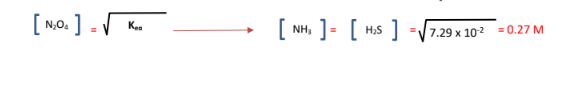
الجواب :
العوامل التي تؤثر في الاتزان الكيميائي
السؤال : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
إذا حدث تغير في أحد العوامل التي تؤثر في نظام متزن ديناميكياً، ي عدل النظام نفسه إلى حالة اتزان جديدة، بحيث يبطل أو يقلل من تأثير هذا التغير. ( مبدأ لوشاتليه )
السؤال : أكمــل العبــارات التاليــة مبا يناسبها علميا
1 - العوامل التي تؤثر( تغير ) في موضع الاتزان تركيز المواد المتفاعلة أو المواد الناتجة و درجة الحرارة و الضغط
2 - عند زيادة تركيز النواتج في نظام متزن، يختل الاتزان ويُزاح موضع الاتزان في اتجاه التفاعل الطردي
وقيمة ( Keq ) تزيد
3- في النظام المتزن التالي : CO(g) + 2H2(g) ⇌ CH3OH(g)
عندما يضاف الهيدروجين إلى النظام المتزن فإن موضع الاتزان يزاح باتجاه المواد .الناتجة الناتجة
4 – العامل الوحيد الذي يغير من قيمة ثابت الاتزان هو درجة الحرارة
5 -في النظام المتزن التالي: (g(2NO) ⇌ g(O2) + g(N2 تزداد قيمة ثابت الاتزان برفع درجة الحرارة مما يدل على أن التفاعل من النوع الماص للحرارة.
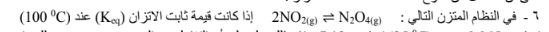
تساوي 0.065 وعند ( 25 ) تساوي فإن ذلك يدل على أن التفاعل من النوع الطارد للحرارة
السؤال : أكمل جدول المقارنة التالي للتفاعل الطارد و التفاعل الماص
| التفاعل ( 1 ) A + حرارة ⇌ B | التفاعل ( 2 ) X ⇌ Y + حرارة |
أ- عند رفع درجة الحرارة ( التسخين ) 3 - تركيز المتفاعلات أقل وتركيز النواتج أكبر | أ- عند رفع درجة الحرارة ( التسخين ) : 1 يختل -الاتزان 2 - يزاح موضع الاتزان نحو تكوين المواد المتفاعلة . 3 - تركيز المتفاعلات أكبر . وتركيز النواتج أقل 4 - القيمة العددية لثابت الاتزان تقل |
السؤال :وضح في الجدول التالي أثر خفض درجة الحرارة على موضع الاتزان، و على قيمة ثابت الاتزان( Keq )
1 – N2(g) + O2(g) ⇌ 2NO(g) , ΔH = + 180 kJ
2- N2(g) + 3H2(g) ⇌ 2NH3(g) , ΔH = - 92 kJ
| التفاعل ( 1 ) | التفاعل ( 2 ) | |
| موضع الاتزان | يزاح موضع الاتزان بالاتجاه العكسي ( اتجاه تكوين النواتج ) | يزاح موضع الاتزان بالاتجاه الطردي ( اتجاه تكوين النواتج ) |
| قيمة ثابت الاتزان | تقل | تزيد |
السؤال: ضع علامة ( √ ) أمام الإجــابة الصحيحــة التـي تكمــل كـلا من العبارات التاليــة :
1 - وفقاً للتفاعل المتزن التالي : (g(2NO) ⇌ g(O2) + g(N2 فإن زيادة الأكسجين تعمل على :
( ) زيادة استهلاك NO
( √ ) زيادة استهالك N2
( ) زيادة قيمة ثابت الاتزان ( Keq )
( ) زيادة سرعة التفاعل العكسي
2- في التفاعل المتزن التالي : FeCl3(aq) + 3KCNS(aq) ⇌ Fe(CNS(aq) + 3 KCl(aq)
جميع ما يلي يزيد من شدة اللون الأحمر عدا :
( ) زيادة ( KCNS )
( ) زيادة تركيز ( FeCl3 ]
( ) تقليل ( KCl )
( √ ) زيادة( KCl ]
3 - في النظام المتزن التالي : (g (O2) + g (SO2 2) ⇌ g (SO3 2 سحب الأكسجين من وسط التفاعل يؤدي إلى :
( ) زيادة قيمة ثابت الاتزان ( Keq )
( √ ) زيادة تركيز SO2
( ) زيادة تركيز SO3
( ) نقص قيمة ثابت الاتزان ( Keq )
السؤال السادس : علل ملا يأتي ؟
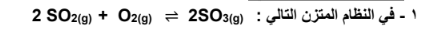
يزداد إنتاج ( SO3 ) عند إضافة المزيد من الأكسجين للتفاعل
الجواب :عند زيادة تركيز إحدى المواد المشتركة في نظام متزن، يزاح موضع الاتزان في اتجاه التفاعل الذي يقلل ولو بعضا من تركيز المادة المضافة ( حسب مبدأ لوشاتليه ) فيزاح موضع الاتزان في الاتجاه الطردي الذي يقلل من الزيادة في تركيز الأكسجين .
2- في النظام المتزن التالي : CO(g) + 2H2(g) ⇌ CH3OH(g) + 92 kJ : يزدلد تفكك كحول الميثيل بارتفاع درجة الحرارة ؟
الجواب :عند ارتفاع درجة الحرارة، يختل الاتزان، وحسب مبدأ لوشاتليه، يزاح موضع الاتزان في الاتجاه العكسي فيزداد تركيز المواد المتفاعلة وفي نفس الوقت تقل كمية النواتج أي يزداد تفكك كحول الميثيل.
تابع العوامل التي تؤثر في الاتزان الكيميائي ( ثالثا : الضغط )
السؤال الاول : أكمل الجدول التالي :
| تفاعلات مصحوبة بزيادة في حجوم الغازات | تفاعلات مصحوبة بنقص في حجوم الغازات | تفاعلات غير مصحوبة بتغير في الحجم |
| يكون فيها عدد مولات الغازات الناتجة أكبر من عدد مولات الغازات المتفاعلة. | يكون فيها عدد مولات الغازات الناتجة أقل من عدد مولات الغازات المتفاعلة | يكون فيها عدد مولات الغازات الناتجة يساوي. عدد مولات الغازات المتفاعلة. |
| 2SO3(g) ⇌ 2SO2(g)+ O2(g) | N2(g) +3H2(g) ⇌ 2NH3(g) | H2(g)+I2(g) ⇌ 2HI(g) |
| عند زيادة الضغط ( تقليل حجم الوعاء ) 1 - يختل الاتزان 2 - يُزاح موضع الاتزان نحو النواتج نحو عدد مولات الغازات الأقل 3 - القيمة العددية لثابت الاتزان لا تتغير | عند زيادة الضغط ( تقليل حجم الوعاء): 1 - يختل الاتزان 2 - يُزاح موضع الاتزان نحو المتفاعلات . نحو عدد مولات الغازات الأقل 3 - القيمة العددية لثابت الاتزان لا تتغير | تغير الضغط ( تغير حجم لأن عدد مولات الغازات |
السؤال الثاني :في الأنظمة المتزنة التالية: هل يتغير موضع الاتزان عند تقليل حجم الوعاء الحاوي لها أم لا ؟ وفي اتجاه يزاح

السؤال الثالث :علل لما يأتي ؟
1- في النظام المتزن التالي : N2(g) + O2(g) ⇌ 2NO(g) , H = + 180 kJ
لا يتغير موضع الاتزان بزيادة الضغط الواقع على النظام
الجواب : لأن عدد مولات الغازات المتفاعلة يساوي عدد مولات الغازات الناتجة
2- في النظام المتزن التالي : N2(g) + O2(g) ⇌ 2NO(g) , H = + 180 kJ
لا يتغير موضع الاتزان عند استعمال عامل حفاز في هذا النظام ؟
الجواب : لأن العامل الحفاز يزيد من سرعة كل من التفاعل الطردي و التفاعل العكسي بالتساوي فهو يسرع من عملية الوصول إلى حالة الاتزان
أسئلة متنوعة على العوامل التي تؤثر في الاتزان الكيميائي
السؤال الأول : اكمل العبارات التالية
1- ثابت الاتزان ( Keq ) N2(g) + 3H2(g) ⇌ 2 NH3(g) + 92kJ
عند K)400 )يكون أكبر من ثابت االتزان له عند K(600 )
2 - عند زيادة الضغط على النظام المتزن التالي : (g(Cl2) + g(CO) ⇌ g(COCl2 يزاح موضع الاتزان في اتجاه تكوين المواد المتفاعلة
3 - عند زيادة حجم وعاء التفاعل المتزن التالي : (g(2NO2) ⇌ g(O2) + g(NO 2 فإن موضع الاتزان يزاح ناحية المواد المتفاعلة
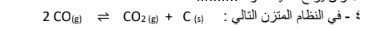
فإن زيادة الضغط على هذا النظام يؤدي إلى زيادة استهلاك غاز ( CO)
السؤال : اختر الإجابة الصحيحة
1- في النظام المتزن التالي : Fe3O4 (s) + 4 H2(g) ⇌ 3 Fe(s) + 4 H2O(g)
لا يتـأثر موضع االتزان بأحد العوامل التالية :
( ) زيادة تركيز Fe
( ) زيادة تركيز Fe2O3
( √ ) نقص حجم وعاء التفاعل
( ) نقص تركيز H2
2-

( ) زيادة تركيز N2
( √ ) زيادة حجم وعاء التفاعل
( ) زيادة الضغط
( ) زيادة تركيز H2
في التفاعل المتزن التالي : C2H6(g) ⇌ C2H4(g) + H2(g) ∆ H = + 138 kJ
يمكن زيادة كمية الإيثين ( C2H4 ) الناتجة
( √ ) برفع درجة الحرارة
( ) بزيادة الضغط
( ) بإضافة الهيدروجين
( ) بخفض درجة الحرارة
4 - جميع العوامل التالية تؤثر على موضع اتزان التفاعل الكيميائي ، عــدا واحداً :
( ) التركيز
( ) الضغـط
( √ ) العامل الحفاز
( ) درجة الحرارة
5 - في النظام المتزن التالي : (g(COCl2) ⇌ g(Cl2) + g(CO يزاح موضع الاتزان في الاتجاه الطردي عند
( ) زيادة تركيز COCl2
( ) زيادة حجم وعاء التفاعل
( ) تقليل تركيزCl2
( √ ) نقص حجم وعاء التفاعل
6- في النظام المتزن التالي : H2(g) + CO2(g) + حرارة ⇌ CO(g) + H2O(g)
يمكن زيادة إنتاج غاز (CO ) عن طريق :
( ) زيادة تركيز بخار الماء وخفض الحرارة
( √ ) رفع درجة حرارة النظام وزيادة تركيز CO2
( ) زيادة الضغط على النظام
( ) خفض درجة حرارة النظام وتقليل تركيز H2
7- في النظام المتزن التالي : I2(g) + H2(g) ⇌ 2 HI(g) , ∆ H = + 52 kJ/mol
يزاح موضع الاتزان ناحية المتفاعلات عنــد :
( ) زيادة الضغط على النظام
( ) رفع درجة حرارة النظام
( ) نقص الضغط على النظام
( √ ) خفض درجة حرارة النظام
8- في النظام المتزن التالي : N2O(g) + 3O2(g) ⇌ 4 NO2(g) , ∆ H = ─ 27 kJ
يمكن زيادة إنتــاج غاز N2O عن طريــق
( ) تقليـل حجم وعــاء التفاعـل
( ) إضافة المزيــد من غاز O2
( √ ) خفض درجـة حـرارة النظـام
( ) رفـع درجـة حـرارة النظام
9- في التفاعل المتزن التالي : PCl3(g) + Cl2(g) ⇌ PCl5(g) + 120 kJ
تقل قيمة ثابت الاتزان ( Keq )
( √ ) بارتفاع درجة الحرارة
( ) بزيادة تركيز غاز الكلور
( ) بزيادة الضغط المؤثر على النظام المتزن
( ) يخفض درجة الحرارة
10 -عند إضافة حمض الهيدروكلوريك إلى النظام المتزن التالي :
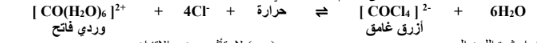
( ) تزداد شدة اللون الوردي
( ) لا يتأثر موضع الاتزان
( √ ) تزداد شدة اللون الأزرق
( ) تزداد قيمة ثابت الاتزان
11- في التفاعل العكوس المتزن التالي : C(s) + CO2(g) ⇌ 2CO(g)
جميع ما يلي يؤدي إلى زيادة إنتاج غاز أول أكسيد الكربون عدا واحدة وهي
( ) بإضافة المزيد من الكربون
( √ ) بزيادة الضغط المؤثر
( ) بسحب غاز CO من وسط التفاعل
( ) زيادة حجم الوعاء
12- عند زيادة تركيز اليود في النظام المتزن التالي : (g(2HI) ⇌ g(I2) + g(H2
والذى يحدث عند درجة حرارة معينة فإن جميع العبارات التالية صحيحة عدا واحدة :
( ) تنشأ حالة اتزان جديدة
( √ ) تزداد قيمة ثابت الاتزان Keq
( ) يزاح موضع الاتزان في اتجاه HI
( ) تبقى قيمة ثابت الاتزان Keq ثابتة
السؤال : ما تأثري كل من التغيرات التالية في موضع اتزان التفاعل العكسي التالي
PCl5(g) + Heat ⇌ PCl3(g) + Cl2(g)
| 1 | إضافة Cl2 | يُزاح موضع الاتزان في الاتجاه العكسي |
| 2 | زيادة الضغط ( تقليل حجم الوعاء ) | يُزاح موضع الاتزان في الاتجاه العكسي |
| 3 | خفض درجة الحرارة | يُزاح موضع الاتزان في الاتجاه العكسي |
| 4 | إزالة PCl3 | يُزاح موضع الاتزان في الاتجاه الطردي |
| 5 | زيادة حجم الوعاء( تقليل الضغط ) | يُزاح موضع الاتزان في الاتجاه الطردي |
الوحدة الثالثة : الأحماض و القواعد
السؤال : أكمل جدول المقارنة التالي بين خواص الأحماض والقواعد
| خواص الأحماض | خواص القواعد |
| 1 -طعمها لاذع | 1 -طعمها مر |
| 2 -تتفاعل المحاليل المائية للأحماض مع الكثير من الفلزات و تعطي ملح الحمض و غاز الهيدروجين | 2- ذات ملمس زلق |
| 3- المحاليل المائية للأحماض توصل التيار الكهربائي ( محاليل إلكترونية ) بعض محاليل الأحماض قوية و أخرى ضعيفة | 3- المحاليل المائية للقواعد توصل التيار الكهربائي ( محاليل إلكترونية ) بعض محاليل القواعد قوية و أخرى ضعيفة |
| 4- تغير ألوان بعض الصبغات الكيميائية الأدلة | 4- تغير الوان بعض الصبغات الكيميائية الأدلة |
| 5- تتفاعل مع القواعد. لتكوين الملح و الماء | 5- تتفاعل مع الاحماض لتكوين الملح و الماء |
نظريات الاحماض و القواعد
1- أحماض و قواعد أرهينيوس
2- أحماض و قواعد برونستد - لوري
3- أحماض وقواعد لويس ( معلق )
السؤال الثاني : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1- مركبات تحتوي على هيدروجين وتتأين لتعطي كاتيونات الهيدروجين ( H+) في المحلول المائي ( أحماض أرهينيوس )
2- المركبات التي تتأين لتعطي أنيونات الهيدروكسيد ( OH- ) في المحلول المائي ( قواعد أرهينيوس )
3 - الأحماض التي تحتوى على ذرة هيدروجين واحدة قابلة للتأين. ( أحماض أحادية الربوتون )
4 - الأحماض التي تحتوي على ذرتي هيدروجين قابلتين للتأين ( أحماض ثنائية الربوتون )
5 - الأحماض التي تحتوى على ثالث ذرات هيدروجين قابلة للتأين.( أحماض ثلاثية الربوتون )
السؤال الثالث :-ضـع علامة ( √ ) أمام الإجابة الصحيحة التي تكمل كلا من العبارات التاليــة :
1 -المركبات التي تتأيــن لتعطي آنيونات الهيدروكسيد -OH في المحلول المائي تسمى :
( ) حمض برون ستد – لـوري
( √ ) قاعـدة أرهينيوس
( ) قاعدة برونستد – لـوري
( ) حمـض أرهينيوس
2 -يمكن تفسير السلوك الحمضي للمواد التالية حسب مفهـوم أرهينيوس عــدا مادة واحدة هي :
( ) H3PO4
( √ ) NH4Cl
( ) HCl
( ) -HSO3
3 -يمكن تفسير السلوك القاعدي للمواد التالية حسب مفهـوم أرهينيوس عــدا مادة واحدة هي :
( ) LiOH
( √ ) CH3COONa
( ) KOH
( ) NaOH
4 -أحــد الأحمــاض التالية أحادي البروتون :
( √ ) CH3COOH
( ) H2CO3
( ) H2SO4
( ) H3PO4
السؤال الرابع : أكمــل العبــارات التاليــة مبا يناسبها علميا
1 - ذرات الهيدروجين التي ترتبط مع ذرة أخرى برابطة قطبية ضعيفة. لا تتأين بينما ذرات الهيدروجين
التي ترتبط مع ذرة أخرى برابطة قطبية .قوية تتأين
2 -هيدروكسيدات المجموعة 1A مثل هيدروكسيد الصوديوم ، هيدروكسيد البوتاسيوم تذوب بسهولة في الماء ولذلك تعطي محاليل مركزة . بينما هيدروكسيدات المجموعة 2A مثل هيدروكسيد المغنسيوم ، هيدروكسيد الكالسيوم لا تذوب بسهولة في الماء ولذلك تعطي محاليل مخففة
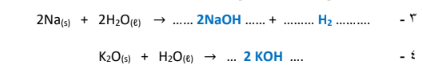
السؤال الخامس : علل لما يأتي ؟
1 -يجب على زوار كهف براكن في مدينة تكساس أن يرتدوا نظارات وأجهزة للتنفس.
الجواب : لحمايتهم من غاز اGhمونيا الخطير ( قاعدة) والذي يتكون كناتج ثانوي من بول الخفاش، حيث يعيش فيه من ( 20 إلى 40 )مليون خفاش .
2 - لا يعتبر الميثان ( CH4 ) من الأحمــاض رغم إحتوائه على الهيدروجين
الجواب : لأن ذرات الهيدروجين الأربع مرتبطة بذرة الكربون برابطة قطبية ضعيفة وبالتالي لا يحتوي الميثان على ذرات هيدروجين قابلة للتأيــن
3 - حمض الأسيتيك أحادي البروتون رغم أنه يحتوي على أربع ذرات هيدروجين .
الجواب : لأنه يحتوي على ذرة هيدروجين واحدة متصلة بذرة أكسيجين ذات سالبية كهربائية عالية ( قطبية عالية ) ولذلك تتأين بينما الذرات الثالث الأخرى تتصل بذرة الكربون برابطة قطبية ضعيفة ولذلك لا تتأين
4 – يُسمى هيدروكسيد الصوديوم NaOH الصودا الكاوية و يُسمى هيدروكسيد البوتاسيوم KOH البوتاسا الكاوية أو هيدروكسيد الصوديوم وهيدروكسيد البوتاسيوم يجب غسلها وإزالتها عن الجلد بالماء في حال لمسها أو انسكابها
الجواب : لأن محاليلها القاعدية المركزة تُسبب ألماً شديداً وتآكالً للجلد ولا يلتئم الجرح الذى تسببه بسرعة، نظراً إلى خواصها الكاوية
ثانيا: أحماض وقواعد برونستد – لوري
السؤال :اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1- المادة ( جزيء أو أيون ) التي تعطي كاتيون هيدروجين H+ ( بروتون ) في المحلول و تسمى معطى بروتون ( حمض برونستد – لوري )
2- المادة ( جزيء أو ايون ) التي تستقبل كاتيون هيدروجين +H ( بورتون ) في المحلول و تسمى مستقبل بروتون ( قاعدة برونستد – لوري )
3- الجزء المتبقي من الحمض بعد فقد البروتون ( القاعدة المرافقة )
4 - الناتج من القاعدة بعد استقبال البروتون ( الحمض المرافق )
5 - كل حمض وقاعدته المرافقة ، أو كل قاعدة وحمضها المرافق. ( الزوج المترافق )
6- هو التفاعل الذي يحدث بين جزيئي ماء لإنتاج انيون هيدروكسيد ( OH - ) وكاتيون هيدرونيوم(H3O+) ( التأين الذاتي للماء )
7 - المواد التي يمكنها أن تسلك كحمض عندما تتفاعل مع القاعدة ، كما يمكنها أن تسلك كقاعدة عندما تتفاعل مع الحمض ( المواد المترددة )
السؤال : أكمل العبارات التالية بما يناسبها علميا

( أ ) : حمض برونستد – لوري هو :H3O+( ب ) : قاعدة برونستد – لوري هي : -NO2
( ج ): القاعدة المرافقة لحمض HNO2 : -NO2 ( د ): الحمض المرافق للماء (H2O ) : +H3O
( هـ) : الأزواج المترافقة هي +HNO2 . NO2 // H2O.H3O
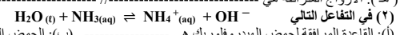
( أ ) : القاعدة المرافقة للماء هي . OH- ( ب ) : الحمض المرافق للامونيا هو +NH4
( ج ) : الأزواج المترافقة هي +H2O.OH- / / NH3.NH4
السؤال الثالث : أكمــل العبارات التالية مبا يناسبها علميــا
1 -الصيغة الكيميائية للقاعدة المرافقة للماء هي -OH. والصيغة الكيميائية لحمضها المرافق هي +H3O
2 -إذا كانت الأزواج المترافقة لتفاعل ما هى : ( CL . HCL ) ( NH4 . NH3 )
فأن التفاعل الدال على ذلك هو :

السؤال الرابع : ضـع علامة ( √ ) م الإجابة الصحيحة التي تكمل كلا من العبارات التالية
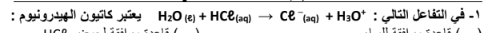
( ) قاعدة مرافقة للمـاء
( ) قاعدة مرافقة لحمض HCl
( ) حمض مرافق لحمض HCl
( √ ) حمض مرافق للماء
2 -أحــد الأنواع التالية يسلك كحــمض وقـاعدة برونس تـد – لوري :
( ) BF3
( √ ) H2O
( ) HCl
( ) 2─CO3
3 -جمـيع الأنواع التالية تسلك ســلوك المترددات عــدا مادة واحدة هي :
( √ ) BF3
( ) H2O
( ) NH3
( ) ─ HCO3
4 -أحــد الأنواع التاليـة لا يعتبر حمــضاً حسـب مفـهـوم برونسـتد – لــوري :
( √ ) BF3
( ) H2O
( ) NH3
( ) - HSO4
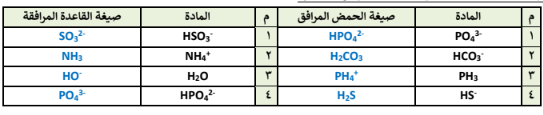
السؤال : اكتب صيغة الحمض المرافق لكل من :
ثالثا : أحماض وقواعد لويس
السؤال الأول :اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1 -المادة( جزيئات أو أيونات ) التي لها القدرة على استقبال زوج أو أكثر من الألكترونات الحرة .( حمض لويس )
2 - هي الجزيئات أو الأيونات التي لها القدرة على إعطاء زوج من الإلكترونات الحرة .( قاعدة لويس )
مثال : وضح حمض وقاعدة لويس في تفاعل ثنائي إيثيل إيثر مع ثالثي فلوريد البورون لإنتاج ثلاثي فلوريد البورون الإيثري
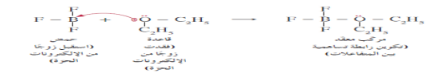
السؤال : أكمل جدول المقارنة التالي :
| حمض لويس | قاعدة لويس |
أ – جزيء متعادل الشحنة يحتوي عىل ذرة لم تصل إلى حالة الإستقرار الثماني وبالتالي يمكنها استقبال زوج ..و أكثر من الإلكترونات من مثل ثالث فلوريد البورون BF3 ، كلوريد الألومنيوم AlCl3. | أ – جزيء متعادل الشحنة يحتوي على ذرة لديها زوج أو أكثر من الإلكترونات الحرة أي غير المشتركة في تكوين روابط من مثل NH3 . H2O ( كحول الإيثيل ) CH3CH2OH ثنائي إيثيل أيثر PCL3 ب- أيون سالب ( أنيون ) حيث تعتبر جميع الانيونات قواعد لويس مثل. 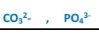
|
السؤال الثالث : حدد محض وقاعدة لويس في التفاعلات التالية
1 - يذوب كلوريد الفضة في محلول الأمونيا حسب المعادلة التالية :
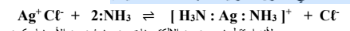
( أ ) : حمض لويس هو - Ag+ Cl لأنه استقبل زوجين من الإلكترونات من جزيئين من الأمونيا وكون معهما روابط تساهمية
( ب ) : قاعدة لويس هي NH3 :2 لأن كل جزيء أمونيا منح زوج من الإلكترونات لتكوين رابطة مع كاتيون الفضة.
2- يتحد آنيون السيانيد ( CN- ) مع كاتيون الهيدروجين ( H+ ) حسب المعادلة التالية :
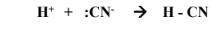
( أ ) حمض لويس هو +H لأنه استقبل زوج من الإلكترونات
( ب ) : قاعدة لويس هي -CN لأنه منح زوج من الإلكترونات
3- حدد حمض و قاعدة لويس في التفاعل التالي
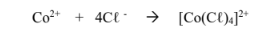
حمض لويس هو : +CO2 وقاعدة لويس هي : -4CL
السؤال الرابع : علل في التفاعل التالي
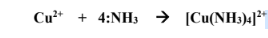
وقاعدة لويس هي + Cu2 حمض لويس هوNH3
الجواب : Cu2+ هو حمض لويس لأنه استقبل زوج من الإلكترونات بينما NH3 هي قاعدة لويس لأنها تمنح زوج من الإلكترونات
تسمية الأحماض و القواعد
أولا : تسمية الأحماض ثنائية العنصر ( غير الاكسجينية ) على الشكل التالي :
حمض + هيدرو + اسم العنصر (A )مضافاً إليه المقطع "يك"
السؤال : أكمل الجدول التالي :
| صيغة الحمض | اسم الحمض | العنصر A | اسم العنصر A |
| HCl | حمض الهيدروكلوريك | CL | الكلور |
| HF | حمض الهيدروفلوريك | F | الفلور |
| HBr | حمض الهيدروبروميك | Br | البروم |
| HI | حمض الهيدرويوديك | I | اليود |
| H2S | حمض الهيدروكربيتيك | S | الكبريت |
| H2Se | حمض الهيدروسلينيك | Se | سيلينيوم |
| H2Te | حمض الهيدروتليريك | Te | تيليريوم |
ثانيا : تسمية الأحماض ثلاثية العنصر (الأكسجينية ) ( HaXbOc)
تسمية الأحماض الأكسجينية من خلال تحديد عدد تأكسد ذرة اللافلز حيث

السؤال الثاني : أكمل الجدول ؟
| م | عدد تأكسد الذرة المركزية | طريقة التسمية | مثال |
| 1 | ( 1+ ) | حمض + هيبو + اسم الذرة المركزية + وز | HClO |
| 2 | ( +3 أو +4 ) | حمض + اسم الذرة المركزية + وز | HNO2 |
| 3 | ( 5+ أو +6 ) | حمض + اسم الذرة المركزية + يك | H2SO4 |
| 4 | ( +7 ) | حمض + بير+ اسم الذرة المركزية + يك | HClO4 |
| 5 | ذرة الكربون تكون حمضا واحدا | حمض + اسم اللافلز + يك | حمض الكربونيك ( H2CO3 ) |
السؤال الثالث : اكمل الجدول التالي
| الصيغة | الاسم | الصيغة | الاسم |
| H2SO4 | حمض الكربيتيك | HClO | حمض الهيبوكلوروز |
| HNO3 | حمض النيتريك | HClO2 | حمض الكلوروز |
| H3PO3 | حمض الفوسفوروز | HClO3 | حمض الكلوريك |
| H2CO3 | حمض الكربونيك | HClO4 | حمض البيركلوريك |
| HNO2 | حمض النيتروز | H2SO3 | حمض الكربيتوز |
تسمية القواعد
السؤال الرابع : أكمل الجدول التالي
| الصيغة | الاسم | الصيغة | الاسم |
| NaOH | هيدروكسيد الصوديوم | Ba(OH)2 | هيدروكسيد الباريوم |
| Ca(OH)2 | الكالسيوم هيدروكسيد | Fe(OH)3 | الحديد هيدروكسيد III |
كاتيونات الهيدروجين و الحموضة
السؤال الأول : اكتب الاسم أو المصطلح العلمي لكل ممــا يلـــي :
1 - المحلول الذي يكــون فيه تركيـز كاتيونات الهيدرونيوم أكبر من تركيز أنيونات الهيدروكسيد.
أو المحلول الذي يكــون فيه. ( H3O ) أكبر من ( OH- ) ( المحلول الحمضي )
2 - المحلول الذي يكــون فيه تركيـز كاتيونات الهيدروجين أقـل من تركيز أنيونات الهيدروكسيد.
أو المحلول الذي يكــون فيه ( +H3O) اقل من ( OH- ) ( المحلول القاعدي )
3 - المحلول الذي يكــون فيه تركيـز كاتيونات الهيدروجين ( الهيدرونيوم ) يساوي تركيز أنيونات الهيدروكسيد .
أو المحلول الذي يكــون فيه ( H3O+ ) = ( OH- ) ( المحلول المتعادل )
4 - حاصل ضـرب تركيـزي كاتيونات الهيدرونيوم وأنيونات الهيدروكسيد في الماء ( ثابت تأين الماء Kw )
السؤال الثاني :- أكمل العبارارات التالية مبا يناسبها علميا
1 -إذا كانت قيمة ثابت تأين الماء( Kw) للماء عند ( 50 C ) تساوي 5.7 × 10*-14 فإن تركيز كاتيون الهيدرونيوم ( H3O + ) في الماء النقي عند هذه الدرجة يساوي 2.38×10-7 M
2 -إذا كانت قيمة ( -O H ) في الماء النقي عند 50 تساوي 2.38 × 10*-7 )فإن ثابت تأين الماء Kw للماء عند هذه الدرجة يساوي 5.7×10-14
3 -اذا علمت أن قيمة KW للماء النقي عند C 47 تساوي 4×10*-14 فإن تركيز أنيون الهيدروكسيد في الماء النفي عند هذه الدرجة يساوي M 2×10-7
السؤال الثالث حــدد نوع المحاليل التالية ( محضــي – قلــوي – متعادل ) :
1 - محلول يحتوي على ( H3O+ ) يساويM ( 1 ×10-3 ) ( حمضي )
2 - محلول يحتوي على يساوي ( OH - )يساوي M ( 1×10-3 ) ( قاعدي )
3 - محلول يحتوي على على ( H3O+ ) يساوي M ( 1×10-9) ( قاعدي )
4- محلول يحتوي على (OH- ) يساوي M ( 1×10-9 ) ( حمضي )
السؤال : ثلاث محاليل ( A.B.C ) موضح تركيز أحد أيونات كل محلول عند 25 أكمل مايلي
| C | B | A | المحلول |
| 1×10-7 | 5×10-12 | 1×10-3 | H3O+ |
| 1×10-1 | 2×10-3 | 1×10-11 | OH- |
| متعادل | قاعدي | حمضي | نوع المحلول |
مفهوم الاس الهيدروجيني pH
السؤال :أكمل الجدول التالي
| الأس الهيدروجيني pH | تعريف الأس الهيدروكسيد pOH | |
| التعريف | القيمة السالبة للوغارتيم العشري لتركيز كاتيون الهيدرونيوم | القيمة السالبة للوغاريتم العشري أنيون الهيدروكسيد |
| القانون | PH=log(H3O+) | POH = -log (OH-) |
| العلاقة بينهما | PH = 14 - POH | pOH =14 -pH |
السؤال : أختر الإجابة الصحيحة من بين الإجابات المعطاه
1- محلول أسه الهيدروكسيدي ( pOH ) يساوي 12 عند 25 C فإن تركيز كاتيون الهيدورنيوم ( H3O +) فيه بوحدة M يساوي
1×10-2
2
0.02 ✓
1×10-12
3- محلول حمضي قيمة الاس الهيدروجيني ( PH ) له تساوي 5.64 عند C 25 فإن تركيز أنيون اليهدروكسيد بوحدة M يساوي
4.365 × 10-9 ✓
2.29×10-6
5.64
8.36
3- أحد المحاليل التالية أكثر حمضية عند C 25
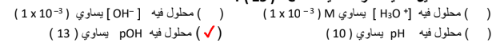
4- أحد المحاليل التالية أكبر قيمة OH- عند 25 C
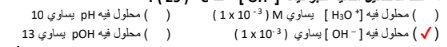
السؤال : ثلاث محاليل ( C.B.A ) موضح إحدى القيم لكل محلول عند 25 C أكمل ما يلي :
| C | B | A | المحلول |
| 1× 10-10 | 1×10-9 | 4×10-3 | H3O+ |
| 1×10-4 | 1×10-5 | 3.98×10-3 | OH- |
| 10 | 9 | 2.4 | PH |
| 4 | 5 | 11.6 | pOH |
| قاعدي | قاعدي | حمضي | نوع المحلول |
السؤال : حل المسألة التالية :
محلول قاعدي فيه تركيز أنيون الهيدروكسيد OH يساوي M 1.5×10-5 عند 25 C المطلوب حساب
أ- قيمة الاس الهيدروكسيلي POH في المحلول
ب- قيمة الأس الهيدروجيني PH في المحلول
ج- تركيز كاتيون الهيدروجين H في المحلول
الجواب :

قوة الأحماض و القواعد
السؤال : أكمل جدول المقارنة التالي :
| الأحماض القوية | الأحماض الضعيفة |
تعــريفها : الأحمــاض التـي تتـأين بشكـل تــام في محاليلها المائية ( تام التأيــن) | تعريفها الأحمــاض التـي تتأين جزئيــاً في محاليلها المائية وتشكـل حالـة اتــزان ( غيــر تام التأيــن ) |
| ينتج كميات كبيرة من كاتيونات الهيدرونيوم | ينتج كميات اقل من كاتيونات الهيدرونيوم |
| التفاعل يسير عمليا حتى نهاية التفاعل غير عكوس | التفاعل لا يسير عمليا حتى النهاية التفاعل عكوس |
| محلوله المائي يحتوي على كاتيونات و انيونات فقط | محلوله المائي يحتوي على كاتيونات و انيونات وجزيئات من الحمض لم تتأين في الماء |
| الاتجاه الغالب يكون باتجاه المواد الناتجة فقط | الاتجاه الغالب يكون باتجاه المواد المتفاعلة |
| لا توجد حالة اتزان عند تأينه لأنه تام التأين | توجد حالة اتزان عند تأينه لأنه غير تام التأين |
| تركيز الحمض غير المتأين يساوي صفر | تركيز الحمض غير المتأين لا يساوي صفرا |
| يتحول الحمض كليا إلى قاعدته المرافقة | لا يتحول الحمض كليا إلى قاعدته المرافقة |
لا يوجد له ثابت تأين Ka مثال " حمض الهيدروكلوريك : HCl 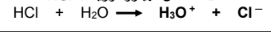 | يوجد له ثابت تأين : Ka حمض الأسيتيك : CH3COOH 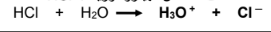 |
السؤال : أختر الإجابة الصحيحة من بين الإجابات المعطاة ؟
1 -إذا كانت قيمة ثابت التأين ( Ka )لكل من حمض الفورميك ولحمض الهيدروفلوريك ولحمض الأسيتيك ولحمض البنزويك هي 1.8 × 10-4 ، 6.7×10-4 ، 1.8 × 10-5 ، 6×10-5 على الترتيب فإن أقوى هذه الأحماض في محاليلها المائية المتساوية التركيز هو حمض :
( ) الفورميك
( ) الأسيتيك
( ✓ ) الهيدروفلوريك
( ) البنزويك
2 -إذا علمت أن ( Ka ) لكل من الأحماض التالية : ( CH3COOH ، HClO ، HCN ) هي 1.8×10-5 ، 3.2 × 10-8 ، 4 × 10-10 على الترتيب فإن فإن ذلك يدل على أن
( ) حمض ( HCN ) هو أقوى الأحماض السابقة
( ✓ ) ( +H ) في محلول ( CH3COOH ) أعلى من ( +H ) في محلول ( HClO ) و الذي له نفس التركيز
( ) قيمة ( pH ) لمحلول ( CH3COOH ) أعلى من قيمة ( pH ) لمحلول ( HCN ) والذي له نفس التركيز
( ) قيمة ( pKa ) لمحلول حمض ( CH3COOH ) تساوي ( 8.6 )
3- -أكثر المحاليل حمضية( C 25 ) هو المحلول الذي يكون له :
( ) 2=PH
( ✓ ) 13=POH
( ) 7=POH
( ) 6.5 = POH
4 -الحمض القوي الذي له الصيغة االفتراضية ( HA ) في محلوله المائي يكون :
( ) متأين جزئيا
( ✓ ) تركيز الجزيء غير المتأين يساوي صفراً
( ) في حالة اتزان ديناميكي
( ) تركيز كاتيونات الهيدرونيوم أقل من تركيز الحمض
5 -المحلول المائي لحمض الهيدروكلوريك ( HCl ) يحتــوي على :
( ) H3O+ وجزيئات من الحمض لم تتأين
( ✓ ) H3O+ -CL فقط
( ) CL- وجزيئات
( ) CL-.H3O+ وجزيئات من الحمض لم تتأين
6 -المحلول المائي لحمض الأسيتيك ( CH3COOH ) يحتــوي على :
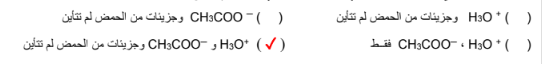
السؤال : أكمل الفراغ
إذا علمت أن Ka لحمض السياتيك تساوي 3.5 × 10-4 ، لحمض الفورميك 1.8 × 10-4 فإن المحلول الذي له أعلى قيمة PH من بين محلوليهما المتساويين في التركيز هو محلول حمض الفورميك
2 – كلما قلت قيمة ثابت التأين ( Ka ) للحمض قلت. قوة الحمض .
3 – كلما قلت قيمة ( PKa ) للحمض .زادت قوة الحمض .
4 – كلما قلت قيمة ( PKa ) للحمض فإن قيمة PH .تقل.
5 - قيمة ثابت التأين الثاني لحمض الفسفوريك أقل من قيمة ثابت التأين األول له
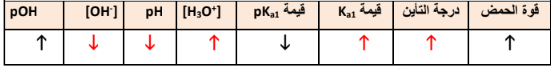
السؤال : أكمل بوضع السهم الدال على الزياده( ⇡ ) أو النقصان ( ⇣ ) ؟
السؤال : ضع علامة ( ✓ ) أمام العبارة الصحيحة وعلامة ( x ) أمام العبارة غري الصحيحة :
1 - الأحماض ثنائية البروتون والأحماض ثلاثية البروتون تفقد الهيدروجين واحدة تلو الأخرى ولا يتم تأين ذرات
الهيدروجين بها في تفاعل واحد وبالتالي يكون لكل تفاعل ثابت التأين الخاص به .( ✓ )
2 – يكون الحمض في مرحلة التأين الأولى أقوى وثابت تأين( Kal ) المرحلة الأولى أكبر . ( ✓ )
3 -تركيز الحمض القوي يساوي تركيز كاتيون الهيدرونيوم . ( ✓ )
4 – كلما قلت قيمة (Ka ) للحمض تزداد قوة الحمض ( × )
السؤال: علل : قيمة الأس الهيدروجيني ( pH )لمحلول تركيزه 1.0 Mمن حمض الهيدروكلوريك ( HCl )أقل من قيمة الأس الهيدروجيني (pH )لمحلول له نفس التركيز من حمض الأسيتيك ( CH3COOH )
الجواب :
لأن حمض الهيدروكلوريك حمض قوي ( HA ) تام التأين

وبالتالي يكون +H3O في محلول حمض الهيدروكلوريك أكبر من +H3O في محلول حمض الاسيتيك و بالتالي فإن قيمة PH لمحلول حمض الهيدروكلوريك أقل من كمية PH لمحلول له نفس التركيز من حمض الاسيتيك
ثانيا : ثابت التأين للقاعدة Kb
| القواعد القوية | القواعد الضعيفة |
القواعد التي تتأين بشكل تام فى محاليلها المائية. مثال: تأين هيدروكسيد الصوديوم فى الماء 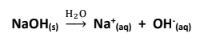 | القواعد التى تتأين جزئياً في محاليلها المائية. مثال: تأين الأمونيا فى المحلول المائي : 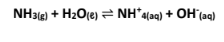 |
السؤال إختر الإجابة الصحيحة من بين الإجابات المعطاة
1 -اذا علمت أن قيمة ( Kb ) لكل من محلول الأمونيا ( 1.8 ×10-6 ) الهيدرازين ( 1.3 × 10-6 ) ميثيل أمين ( 4.4×10-4 ) ايثيل أمين ( 6.4×10-4 ) فإن أقوى هذه القواعد في محاليلها المائية المتساوية التركيز هو :
( ) محلول الامونيا
( ) الهيدرازين
( ) ميثيل أمين
( ✓ ) ايثيل أمين
2 -اذا علمت أن قيمة ( Kb ) لكل من محلول الأمونيا ( 1.8 × 10-6 ) الهيدرازين ( 1.3 × 10-6 ) ميثيل أمين ( 4.4 × 10-4 ) غيثيل أمين ( 6.4×10-4 ) فإن أكبر قيمة PH في محاليلها المائية المتساوية التركيز هو :
( ) محلول الأمونيا
( ) الهيدرازين
( ✓ ) ميثيل أمين
( ) ايثيل أمين
السؤال الثاني : أكمل الفراغ
1 - إذا كانت قيمة Kb للأنيلين تساوي 4.6 × 10-10 و للهيدرازين تساوي 9.8× 10-7 فإن المحلول الذي يكون تركيز كاتيون الهيدروجين ( H+ ) فيه أقل من محلول الهيدرازين
2 – كلما قلت قيمة ثابت التأين ( Kb ) للقاعدة قلت قوة القاعدة .
3 – كلما قلت قيمة ( PKb ) للقاعدة زادت قوة القاعدة .
4 – كلما قلت قيمة ( PKb ) للقاعدة فإن قيمة PH تزيد
5 -إذا كانت قيمة ثابت التأين ( Ka ) لكل من حمض الأسيتيك وحمض الفورميك تساوي ( 1.8 × 10-5 ، 1.8 × 10-4 )
على الترتيب ، فإن المحلول الذي له أقل تركيز كاتيون هيدروجين من بين محلوليهما المتساويين في التركيز هو محلول حمض الأسيتيك
6 -أذا كانت قيمــة ( pKa ) لكل من حمض الأسيتيك وحمض الهيبوكلوروز وحمض الهيدروسيانيك وحمض البنزويك هي ( 74.3 , 49,7 , 39.9 , 2.4 ) على الترتيب فإن أقوى هذه الأحماض في محاليلها المائية والمتساوية التركيز هو حمض .الأسيتيك
السؤال : أكمل بوضع السهم الدال على الزياده( ⇡ ) أو النقصان ( ⇣ ) ؟
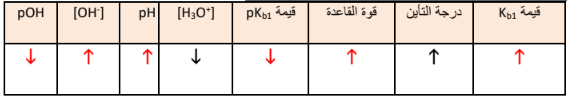
السؤال : ضع علامة ( ✓ ) أمام العبارة الصحيحة وعلامة ( x ) أمام العبارة غير الصحيحة :
1 - تتأين القواعد القوية بالكامل إلى كاتيونات فلزية وأنيونات هيدروكسيد فى محاليلها المائية لذا ليس لديها ثابت تأين. ( ✓ )
2 - بعض القواعد القوية مثل هيدروكسيد الكالسيوم وهيدروكسيد المغنيسيوم شحيحة الذوبان فى الماء. ولكن الكميات الصغيرة التى تذوب فى الماء من تلك القواعد تتأين تماماً.( ✓ )
3 – كلما قلت قيمة ( Kb ) للقاعدة تزداد قوة القاعدة ( × )
4 -عند تأين القاعدة القوية فإن تركيز القاعدة ( احادية الهيدروكسيد ) يساوي تركيز أنيون الهيدروكسيد. ( ✓ )

