تعريفات وتعليلات كيمياء ثاني عشر علمي ف1 #أ. أسامة مسعود
الوحدة الأولى : الغازات
1- علم الأرصاد الجوية : هو العلم الذي يدرس أحوال الطقس ويحاول توقعها بتحليل مجموعة من المتغيرات أهمها الضغط الجوي و الحرارة وسرعة الرياح واتجاهها و درجة الرطوبة
2- المادة : هي كل ماله كتلة ويشغل حيزا من الفراغ
3- النظرية الحركية : نظرية تفترض أن الغازات تتكون من جسيمات كروية الشكل صغيرة للغاية و تتحرك بسرعة في حركة عشوائية مستقيمة
4- ضغط الغاز : العامل الذي يتيح عن تصادم جسيمات الغاز بجدران الوعاء الحاوي لها
5- درجة الحرارة : المتغير الذي يغير من متوسط الطاقة الحركية لجسيمات الغاز
6-قانون بويل : يتناسب الحجم الي تشغله كمية معينة من غاز ما تناسبا عكسيا مع ضغط الغاز عند درجة حرارة ثابتة
7- قانون تشارلز : يتناسب حجم كمية معينة من الغاز تتناسب طرديا مع درة الحرارة المطلقة بالكلفن K عند ثبات الضغط وكمية الغاز
8- الضفر المطلق O K او 273 C : هي أقل درجة حرارة ممكنة أي هي درجة الحرارة التي تساوي عندها متوسط الطاقة الحركية لجسيمات الغاز صفرا نظريا
9- قانون جاي لوساك : عند ثبات الحجم فإن ضغط كمية معينة من الغاز يتناسب طرديا مع درجة حرارتها المطلقة
10- الظروف القياسية : الظروف التي يكون عندها ضغط الغاز 101.3 kpa و درجة حرارتها 273k
11- الغاز المثالي : هو غاز افتراضي يحقق جميع فرضيات النظرية الحركية عند جميع الظروف م الضغط و درجة الحرارة
12- الغاز الحقيقي : هو الغاز الذي يمكن استاله تحت ضغط عالي و تبريد مرتفع
13-فلاضية افوجادرو : الحجوم المستاوية من الغازات المختلفة عند درجة الحرارة و الضغط نفسيهما تحتوي على أعداد متساوية من الجسيمات
14- الحجم المولي للغاز : الجحم الذي يشغله مول واحد من الغاز في الظروف القياسية ويساوي 22.4 L
15- الضغط الجزئي للغاز : الضغط الناتج عن أحد مكونات خليط غازي إذا شغل حجما مساويا لحجم الخليط عند درجة الحرارة نفسها
16- قانون دالتون للضغوط الجزيئية : عند ثبات الحجم و درجة الحرارة يكون الضغط الكلي لخليط من عدة غازات لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزيئية للغازات المكونة للخليط
السؤال : الغازات في صناعة الوسائد الهوائية وفي أجهزة الأمان. علل.
الجواب : لقابلية الغازات للانضغاط نظرا لتباعد جسيمات الغاز عن بعضها البعض فيسهل ضغط الغاز.
السؤال : كيف تفسر النظرية الحركية قابلية الغازات للانضغاط؟
الجواب : حسب النظرية الحركية للغازات فإن جسيمات الغاز صغيرة للغاية بالمقارنة مع المسافات التي تفصل بينها أي أن هذه الجسيمات متباعدة بعضها عن بعض بدرجة كبيرة حيث ميكن تقريب المسافة بينها عند زايدة الضغط.
السؤال: حجوم جسيمات الغاز غير مهمة بالنسبة للحجم الذي تشغله تلك الجسيمات. علل.
الجواب : حسب النظرية الحركية للغازات فإن جسيمات الغاز صغيرة للغاية بالمقارنة مع المسافات التي تفصل بينها أي أن هذه الجسيمات متباعدة بعضها عن بعض بدرجة كبيرة حيث ميكن تقريب المسافة بينها عند زايدة الضغط.
السؤال : تأخذ الغازات شكل وحجم الوعاء الحاوي لها. علل.
الجواب : لانعدام قوي التجاذب بين جسيمات الغاز فتكون حرة الحركة لتأخذ شكل وحجم الوعاء الحاوي لها
السؤال : تفترض النظرية الحركية أن التصادمات بين جسيمات الغاز مرنة تمام .علل.
الجواب : لان الكمية الكلية للطاقة الحركية تظل ثابتة أثناء الاصطدام وطاقة الحركة تنتقل من جسم إلى اخر دون هدر.
السؤال : الكمية الكلية للطاقة الحركية لجسيمات الغاز تظل ثابتة. علل.
الجواب : لأن التصادمات بني جسيمات الغاز تمتاز بأنها تصادمات مرنة، أي أن الطاقة الحركية تنتقل من جسيم لآخر دون هدرأي منها ولذلك تبقى الكمية الكلية للطاقة الحركية اثبتة أثناء الاصطدام.
السؤال : تحدث جسيمات الغاز ضغطا على جدار الوعاء الحاوي لها. علل.
الجواب : نتيجة التصادمات المستمرة والمرنة بين هذه الجسيمات وجدار الوعاء.
السؤال : ماذا تتوقع أن يحدث في الحالات التالية مع ذكر السبب:
1 -إضافة كمية كبرية من الهواء داخل إطار السيارة.
الجواب :
- التوقع : يزداد الضغط إلى أن ينفجر الاطار.
- السبب : لأن زايدة كمية الغاز تؤدي لزايدة عدد جسيمات الغاز و بالتالي تزداد التصادمات بني جسيمات الغاز وجدران الإطار
2 -تقليل كمية الغاز داخل إطار السيارة.
الجواب :
- التوقع : يقل الضغط.
- السبب : لأن تقليل كمية الغاز تؤدي لتقليل عدد جسيمات الغاز وبالتالي تقل التصادمات بين جسيمات الغاز وجدران الإطار .
3 -عند مضاعفة كمية الغاز ثلاث مرات داخل وعاء ذو حجم ثابت.
الجواب :
- التوقع : يتضاعف الضغط ثلاث مرات .
- السبب :لأن مضاعفة عدد جسيمات الغاز إلى ثلاثة أضعاف تؤدي إلى زايدة الضغط بنفس الضعف ، حيث أن العلاقة طردية بني كمية الغاز والضغط .
4 -عند تقليل كمية الغاز للنصف داخل وعاء ذو حجم ثابت .
الجواب :
- التوقع : يقل الضغط للنصف .
- السبب : لأن تقليل عدد جسيمات الغاز إلى النصف في حجم ثابت يؤدي لتقليل الضغط للنصف .
السؤال :لكي تعمل عبوات الرذاذ ال بد أن تحتوي على غاز تحت ضغط عالي " أعلى من الضغط الجوي" .علل.
الجواب : لأن الغاز ينتقل من الحيز ذو الضغط الأعلى " داخل العبوة " للحيز ذو الضغط الأقل " خارج العبوة " فيندفع الغاز حاملا معه المادة السائلة .
السؤال : يندفع السائل المحبوس داخل عبوات الرذاذ عند الضغط على الصمام. علل.
الجواب : لأهنا تحتوي على غاز دفعي تحت ضغط مرتفع و عند الضغط على زر عبوة الرذاذ نحدث فتحة يندفع خلالها الغاز الدفعي ذو الضغط المرتفع الموجود من داخل عبوة الرذاذ إلى المنطقة الخارجية ذات الضغط الأقل حاملا معه السائل إلى الخارج على شكل رذاذ
السؤال : يقل الضغط داخل عبوة الرذاذ عند الاستمرار بالضغط على صمام العبوة. علل.
الجواب : لان الغاز ينتقل من الحيز ذو الضغط الأعلى " داخل العبوة " للحيز ذو الضغط الأقل " خارج العبوة " فتقل كمية الغاز و يقل عدد جسيماته املتصادمة ما يسبب تقليل الضغط بداخل العبوة.
السؤال : يقل حجم الغاز المحبوس بزيادة الضغط على الوعاء عند ثبوت درجة الحرارة. علل.
الجواب : لأن زايدة الضغط يؤدي إلى تقليل المسافات البينية بين جسيمات الغاز ، فيقل الحيز الذي تشغله تلك الجسيمات .
السؤال : تقليل حجم الوعاء يؤدي لزيادة الضغط داخل الوعاء. علل.
الجواب : لان تقليل حجم الوعاء يعمل على تقليل المسافات البينية بين جزيئات الغاز فتزداد التصادمات بين جسيمات الغاز ولجدار الحاوي هلا فيزداد الضغط.
السؤال : زيادة حجم الغاز المحبوس يؤدي إلى تقليل الضغط عند ثبوت درجة الحرارة . علل.
الجواب : لأن زيادة حجم الغاز يؤدي إلى زايدة المسافات البينية بين جزيئات الغار فتقل التصادمات فيقل الضغط.
السؤال : أكياس البطاطا الجاهزة تبدو وكأنها منتفخة عند وضعها في أماكن تصلها الشمس؟
الجواب : عندما تكتسب الجسيمات طاقة حرارية فإن متوسط سرعة حركة جسيمات الغاز يزداد ويزداد معدل و قوة تصادم جزيئات الغاز مع جدران الوعاء و ابلتايل متارس ضغطا أكبر
السؤال : خطورة إلقاء عبوة الرذاذ في النار بعد استخدامها؟
الجواب : لأنها تحتوي على غازات تحت ضغط مرتفع و بارتفاع درجة الحرارة يزداد متوسط الطاقة الحركية للجزيئات فيزداد معدل التصادمات و قوتها بين جسيمات الغاز و جدران العبوة فيزداد الضغط داخلها مما يؤدي إلى انفجارها و التسبب في اضرار.
السؤال : تملأ إطارات السيارات بكمية من الهواء صيفا أقل منها شتاءا. علل.
الجواب : صيفا ترتفع درجة الحرارة و يزداد متوسط طاقة حركة جزيئات الغاز و يزداد معدل و قوة تصادماتها مع جدار الاطار فيزداد الضغط داخل الاطار مما قد يؤدي إلى انفجاره بذلك نقلل كمية الهواء داخله صيفا، شتاءا تنخفض درجة الحرارة و يقل متوسط طاقة حركة جزيئات الغاز و يقل معدل و قوة تصادماتها مع جدار الإطار فيقل الضغط داخل الإطار لذلك نزيد كمية الهواء داخله شتاء .
السؤال : ترتفع كتل الهواء الساخن فوق الهواء البارد ؟
الجواب : لان الهواء الساخن أثل كثافة من الهواء البارد
السؤال : يرتفع المنطاد إلى أعلى عند تسخين الهواء المحبوس فيه؟
الجواب : لأنه عند تسخين الهواء المحبوس في المنطاد تزداد متوسط طاقته الحركية فيزداد حجمه وبالتالي تقل كثافته فيرتفع لأعلى.
السؤال : يقل حجم كمية معينة من الغاز عند زيادة الضغط وثبوت درجة الحرارة. علل.
الجواب : لأن المسافات البينية بني جزيئات الغاز كبية ولا توجد قوى تنافر بينها و عند زايدة الضغط تقترب جزيئات الغاز من بعضها البعض ويصغر حجمه بشكل كبير
السؤال : يتضاعف ضغط الغاز المحبوس عندما يقل الحجم إلى النصف عند ثبوت الحرارة. علل.
الجواب : لأن تقليل الحجم إلى النصف يضاعف عدد التصادمات لجسيمات الغاز مع جدران الوعاء وبالتالي يتضاعف الضغط.
السؤال : تستخدم درجات الحرارة بالكلفن في الحسابات المتعلقة بالغازات. علل.
الجواب : لأن درجات الحرارة بالكلفن دائما موجبة وتتناسب تناسبا طرديا مع متوسط الطاقة الحركية لجسيمات الغاز.
السؤال :يكون مقياس العلاقة بين الحجم ودرجة الحرارة من الناحية العملية في مدى محدود فقط. علل.
الجواب : لأن الغازات تتكثف عند درجات حرارة منخفضة لتكون سوائل.
السؤال : ما هو تأثير رفع حرارة غاز ما في بالون عند ثبات الضغط؟
الجواب : يزداد متوسط الطاقة الحركية لجسيمات الغاز و كلما ازدادت الطاقة الحركية زاد معدل التصادمات و قوهتا مع جدران البالون فيزداد ضغط الغاز الداخلي على جدران البالون فتزداد المسافات البينية بين جزيئات الغاز و التي تعمل على زايدة حجم البالون.
السؤال : لا تحرق أو تخزن عبوات الرذاذ فوق درجات حرارة معينة. علل.
الجواب : لأن ضغط الغاز المحبوس داخل تلك العبوات يرتفع عند تسخينه وإذا زاد عن الحد المحتمل يمكن أن ينفجر الوعاء ويسبب أضرار جسيمة.
السؤال : يزداد ضغط غاز ما في وعاء مغلق عند حجم ثابت بارتفاع درجة حرارته. علل.
الجواب : عندما تكتسب الجسيمات طاقة حرارية فإن متوسط سرعة حركة جسيمات الغاز يزداد ويزداد معدل و قوة تصادم جزيئات الغاز مع جدران الوعاء و بالتالي تمارس ضغطا أكبر
السؤال : يزداد الضغط عند تسخين غاز في وعاء مغلق. علل.
الجواب : عند ارتفاع درجة الحرارة تزداد الطاقة الحركية للجزيئات فتتحرك الجزيئات بسرعة لتصطدم بجدران الوعاء فيزداد معدل التصادمات وقوتها مع جدران الوعاء مما يزيد الضغط لأن الضغط ينشأ عن اصطدام جزيئات الغاز بجدران الوعاء.
السؤال : لا وجود للغاز المثالي أو الغاز المثالي غاز افتراضي. علل.
الجواب : لأن جسيمات الغاز تملك حجم محدود وتنجذب ببعضها البعض.
السؤال : يمكن اسالة الغاز بالضغط والتبريد الشديدين. علل.
الجواب : لان الضغط يعمل على اقتراب جزيئات الغاز من بعضها البعض والتبريد يعمل على تقليل الطاقة الحركية للجزيئات فتزداد قوى التجاذب بينهما مما يؤدي إلى تحولها من الحالة الغازية إلى الحالة السائلة
السؤال : يمكن اسالة الغاز الحقيقي فيما لا يمكن اسالة الغاز المثالي علل.
الجواب : لأن الجسيمات في الغاز المثالي ليس لها حجم و لا ينجذب بعضها إلى بعض، أما في الغاز الحقيقي فإن الجسيمات لها حجم وتوجد بينها قوى تجاذب، والضغط والتبريد يعملان على تقارب الجسيمات فيكون لها حجم و قوة تجاذب و تتحول إلى الحالة السائلة
السؤال : تفترض النظرية الحركية أن جسيمات الغاز لا تنجذب بعضها إلى بعض وليس لها حجم وهذه الفرضية غير صحيحة. علل.
الجواب : لأنه إذا انعدمت قوى التجاذب بين جسيمات الغاز لا يمكن اسالته وتتكون الغازات من جسيمات فيزايئية حقيقية لها حجم ولذلك يصعب ضغط الغاز بعد نقطة معينة مهما كان الضغط الواقع عليها.
السؤال : عند نفس الظروف من الضغط ودرجة الحرارة وبغض النظر عن حجم الجسيمات فإن نفس العدد من
جسيمات الغازات المختلفة تشغل حجوما متساوية. علل.
السؤال : يمكن لنفس الوعاء أن يحتوي على نفس العدد من الجسيمات الكبيرة أو الصغيرة عند نفس الظروف من الضغط والحرارة. علل.
الجواب : لان جسيمات الغاز تكون متباعدة ولا يفصل بينها إلا الفراغ و بالتالي فإن الجسيمات الكبيرة نسبيا لا تحتاج فراغ أكبر مقارنة بنفس العدد من الجسيمات الصغية نسبيا .
السؤال : على الرغم من اختلاف الكتل المولية للغازات لكن الكميات المتساوية منها تحدث ضغطا متساويا إذا
شغلت حجوم ودرجات حرارة متساوية. علل.
الجواب : لتساوي عدد جسيمات الغاز وبالتالي يكون لكل غاز نفس كمية التصادمات و بنفس الضغط عند ثبوت درجة الحرارة.
السؤال : يشغل نصف مول من غاز الهيليوم 4= He حجما مساويا لحجم نصف مول من غاز النيون 20 = Ne في
الظروف القياسية . علل.
الجواب : لأن عدد جسيمات كلا من الغازين متساوي و المول من الغاز يشغل حجما قدره L 4.22 في الظروف القياسية.
السؤال : حجم بالون يحتوي على 11g من غاز ثاني أكسيد الكربون 44= CO2 يساوي حجم بالون يحتوي على 5g من
غاز النيون 20 = Ne عند الظروف القياسية. علل.
الجواب :

لأن عدد مولات غاز النيون تساوي عدد مولات غاز اثين أكسيد الكربون عند الظروف القياسية وبالتالي طبقا لفرضية أفوجادرو فإن كال الغازين يشغلان نفس الحجم.
الوحدة الثانية : سرعة التفاعل
1- سرعة التفاعل الكيميائي : كمية المتفاعلات التي يحدث لها تغير خلال وحدة الزمن
هو التغير في عدد المولات خلال فترة زمنية معينة
2- نظرية التصادم : نظرية تنص على أن الجزيئات و الذرات و الايونات التي يصطدم بعضها ببعض بطاقة حركية كافية في الاتجاه الصحيح يمكن ان تتفاعل و تكون نواتج
3- طاقة التنشيط : أقل كمية من الطاقة التي تحتاج إليها الجسيمات لتتفاعل
4- المركب المنشط : هو ترتيب مؤقت للجسيمات التي لها طاقة كافية لكي تكون مواد متفاعلة أو مواد ناتجة
5-المادة المحفزة : مادة تزيد من سرعة التفاعل دون أن تستهلك فيه ويمكن فصلها بعد انتهاء التفاعل
6- الانزيمات : المواد المحفزة الحيوية التي تزيد من سرعات التفاعلات البيولوجية كهضم البروتينات
7-المادة المانعة للتفاعل : مادة تبطء التفاعل أو تعمل على انعدامه
8- التفاعلات الغير عكوسة : هي تفاعلات تحدث في اتجاه واحد حتى تكتمل بحيث لا تسطيع المواد الناتجة من التفاعل مع بعضها لتكوين المواد المتفاعلة مرة أخرى
9- التفاعلات العكوسة : هي تفاعلات لا تستمر في اتجاه واحد بحيث لا تستهلك المواد المتفاعلة كليا لتكوين النواتج بحث ان المواد الناتجة تتحد مع بعضها ثانية لتكوين المتفاعلات مرة أخرى تحت نفس الظروف
10- التفاعلات العكوسةالمتجانسة : تفاعلات عكوسة تكون فيها جميع المواد المتفاعلة و المواد الناتجة من التفاعل في نفس الحالة الفيزيائية
11- التفاعلات العكوسة الغير متجانسة : تفاعلات عكوسة تكون المواد فيها المتفاعلة و المواد الناتجة من التفاعل في أكثر من حالة فيزيائية
12- قانون فعل الكتلة : عند ثبات درجة الحرارة تتناسب سرعة التفاعل الكيميائي طرديا مع تراكيز المواد المتفاعلة كل مرفوع إلى أس يساوي عدد مولاته أمام كل مادة من المعادلة الكيميائية الموزونة
13- الاتزان الكيميائي الديناميكي : حالة النظام التي تثبت فيها تراكيز المواد المتفاعلة و المواد الناتجة و بالتالي تكون سرعة التفاعل الطردي مساوية لسرعة التفاعل العكسي طالما بقي النظام بعيدا عن اي مؤثر خارجي
14- موضع الاتزان : عبارة عن التراكيز النسبية للمواد المتفاعلة و المواد الناتجة عند الاتزان
15- ثابت الاتزان Keq: هو النسبة بين حاصل ضرب تراكيز المواد الناتجة من التفاعل إلى حاصل ضرب تراكيز المواد المتفاعلة كل مرفوع إلى الأس المساوي لعدد مولاته في المعادلة الموزونة
16- مبدأ لوشاتيليه : إذا حدث تغير في أحد العوامل التي تؤثر في نظام متزن ديناميكيا ، يعدل النظام نفسه إلى حالة اتزان جديدة ، بحيث يبطل أو يقلل من تأثير هذا التغير
17- الإزاحة في موضع الاتزان : اختلاف موضع الاتزان عن موضعه الاصلي بحيث يحدث تغير في كميات المواد المتفاعلة أو المواد الناتجة سواء بالزيادة أو النقصان
السؤال : يرتدي عمال اللحام نظارات خاصة عند لحام المعادن باستخدام غاز الإيثاين و الأكسجين. علل.
الجواب : لأن تفاعل غاز الإيثين مع الأكسجين ينتج لهب درجة حرارته كبيرة جدا تصل إلى أكثر من C 300
السؤال : لا يكفي تصادم جسيمات المادة مع بعضها البعض لكي تتفاعل. علل.
الجواب : لانه وفق نظرية التصادم فإن الذرات والأيونات و الجزيئات التي يصطدم بعضها ببعض بطاقة حركية كافية في الاتجاه الصحيح يجب ان تتغلب على حاجز التنشيط لكي تتفاعل و تكون نواتج و أن يكون لها توجيه في الاتجاه الصحيح
السؤال : يسمى المركب المنشط أحيانا بالحالة الانتقالية. علل.
السؤال :المركب المنشط غير مستقر بدرجة كبيرة وتبلغ فترة عمره s.1x10
الجواب : لانه غير مستقر بدرجة كبية حيث ما أن يتكون حىت يتفكك مرة أخرى ليعطي إما مواد متفاعلة أو يستمر ليكون النواتج إذا توافرت طاقة كافية و توجه صحيح للذرات.
السؤال : سرعة تفاعل الكربون مع الاكسجين عند درجة حرارة الغرفة تساوي صفرا .علل.
الجواب : عند درجة حرارة الغرفة لا تكون التصادمات بين جزيئات الاكسجين و ذرات الكربون فعالة و نشطة بدرجة كافية لكسر روابط O-C , O-O و لاتمتلك الجزيئات طاقة حركية كافية لكي تصطدم في الاتجاه الصحيح و تجتاز حاجز طاقة النشيط
السؤال : لا يحترق الفحم بسرعة يمكن قياسها عند درجة حرارة الغرفة لكن عند امداده بطاقة كافية في صورة حرارة فإنه يحترق. علل.
الجواب :لأنه عنج ملامسة اللهب فإن عدد الجسميات التي تمتلك طاقة حركية كافية لكي تصطدم تصادمات فعالة في الاتجاه الصحيح فتختار حاجز طاقة التنشيط تزداد وبالتالي تزداد سرعة التفاعل
السؤال : يشتعل عود الثقاب فورا بمجرد حكة بسطح خشن. علل.
الجواب : لأن الحرارة المتولدة من الاحتكاك تكون كافية لاستمرار التفاعل وتخطي حاجز التنشيط.
السؤال : ارتفاع درجة حرارة المواد المتفاعلة يؤدي إلى زيادة سرعة تفاعلها. علل.
الجواب : لانه بارتفاع درجة حرارة الجسيمات المتفاعلة يزداد متوسط الطاقة الحركية لها فتزداد سرعتها ويزداد احتمال تصادمها مما يؤدي إلى زايدة عدد الجسيمات ذات الطاقة الحركية الكافية لكي تصطدم تصادمات فعالة في الاتجاه الصحيح وتتخطى حاجز طاقة التنشيط و بذلك تزداد سرعة التفاعل.
السؤال : يفسد الطعام بسرعة إذا ترك في درجة حرارة الغرفة بينما يبقى صالحا لمدة أطول عند وضعة في الثلاجة. علل.
الجواب :
1- لأن في درجة الحرارة الغرفة تكون الطاقة كافية لإمداد جسيمات المواد المتفاعلة بالطاقة ويزداد متوسط الطاقة الحركية ويزداد عدد الجسيمات ذات الطاقة الحركية الكافية لتخطي حاجز طاقة التنشيط عند اصطدامها وتكون التصادمات بطاقة حركية كافية وفي لاتجاه الصحيح ما يساعد على إفساد الطعام بسرعة أكبر.
2- بينما في الثلاجة تنخفض درجة الحرارة ويقل متوسط الطاقة الحركية لجسيمات المواد المتفاعلة ويقل عدد الجسيمات ذات الطاقة الحركية الكافية لتخطي حاجز طاقة التنشيط عند اصطدامها ما يؤدي إلى بطء تفاعل فساد الطعام.
السؤال : يمنع التدخين في المناطق التي تستخدم فيها الانابيب المعبأة بالأكسجين. علل.
السؤال : علل: يزداد توهج عود الثقاب عند وضعه في زجاجة مملوءة بغاز الأكسجين النقي. علل.
الجواب : زيادة تركيز الاكسجين يزيد تفاعل الاحتراق و في هذه المناطق يزداد تركيز الاكسجين و الحرارة الناتجة عن التدخين بالقرب من الاكسجين تؤدي الى زيادة عدد الجسيمات التي تمتلك طاقة حركية كافية لكي تصطدم تصادمات فعالة في الاتجاه الصحيح و تجتاز حاجز طاقة التنشيط فتحدث عملية احتراق سريعة.
السؤال : يدرك عمال المناجم أن كتل الفحم الكبيرة قدلا تشكل خطرا بقدر غبار الفحم المعلق و المتناثر في الهواء .علل.
الجواب : لأن غبار الفحم نشط للغاية وقابل للانفجار لأنه كلما قل حجم الجسيمات زادت مساحة السطح المعرضة للتفاعل و يزداد معدل التصادمات الفعالة بين جسيمات الفحم و الاكسجين مما يجعل هذه الجسيمات قابلة للتفاعل بسرعة كبيرة و بالتالي حدوث انفجار.
السؤال :يفضل طحن المادة الصلبة وتحويلها الى مسحوق ناعم أثناء التفاعل. علل.
الجواب : عند الطحن يصغر حجم جسيمات المادة وتزداد مساحة السطح لكتلة معينة و تزداد كمية المادة المعرضة للتفاعل فيزداد معدل التصادمات الفعالة و يزداد عدد الجسيمات التي تمتلك طاقة حركية كافية لكي تصطدم في الاتجاه الصحيح و تجتاز حاجز طاقة التنشيط فتزيد سرعة التفاعل الكيميائي.
السؤال : يفضل إضافة المواد المحفزة إلى التفاعل. علل.
الجواب : لأن المادةة المحفزة تعمل على تقليل طاقة حاجز التنشيط حيث أنه يكون أكثر انخفاضا في حالة التفاعل المحفز مما يؤدي إلى زايدة سرعة التفاعل من خلال إيجاد آلية بديلة للتفاعل بالمقارنة مع التفاعل غير المحفزة
السؤال : إضافة مادة مانعة للتفاعل لبعض التفاعلات. علل.
الجواب : لتقليل سرعة بعض التفاعلات حيث أن المادة المانعة تعارض تأثير المادة المحفزة فتقلل من تأثيرها يؤدي لبطء التفاعلات أو انعدامها.
السؤال : لا يعتبر التفاعل التالي من التفاعلات العكوسة. علل.

الجواب : لأن المواد المتفاعلة تستهلك تماما و المواد الناتجة من التفاعل لا تستطيع أن تتحد بعضها مع بعض ليكون المواد المتفاعلة مرة أخرى
السؤال : يعتبر التفاعل التالي من التفاعلات العكوسة المتجانسة. علل.
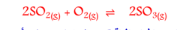
الجواب : لأن المواد المتفاعلة لاتستهلك تماما , و المواد الناتجة من التفاعل تستطيع أن تتحد ببعضها البعض لتكوين المواد المتفاعلة مرة أخرى و متجانس لأن المواد المتفاعلة و الناتجة في حالة واحد من حالات المادة
السؤال : تبقى تراكيز المواد المشتركة في التفاعل العكوس ثابتة طالما وصل النظام إلى حالة الاتزان الكيميائي .علل.
الجواب : لأن سرعة التفاعل الطردي تكون مساوية لسرعة التفاعل العكسي.
السؤال : إضافة المادة المحفزة لتفاعل متزن لا تؤثر على موضع الاتزان؟
الجواب : لأن المادة المحفزة تسرع التفاعل الطردي و التفاعل العكسي بدرجة متساوية من دون التأثير في كمية المواد المتفاعلة و المواد الناتجة الموجودة عند الاتزان أي أنها ببساطة تقلل الفتة الزمنية للوصول إلى الاتزان.
السؤال : تعبير ثابت الاتزان لا يشتمل على المواد الصلبة. علل.
الجواب : لأن تركيز المادة الصلبة ثابت ويساوي الواحد 1M.
السؤال : لا يشمل تعبير ثابت الاتزان الماء في الحالة السائلة في المتفاعلات. علل
الجواب : لأن الماء في التفاعلات يعمل كمذيب بالتالي يكون تركيزه ثابت ويساوي الواحد.
السؤال : في النظام المتزن التالي : FeCl3 (aq) + 3 KCNS (aq) ⇌ Fe(CNS)3 (aq) + 3KCl (aq) :
إذا علمت ان محلول Fe (CNS)3 فإنه عند إضافة المزيد من كلوريد البوتاسيوم تقل شدة اللون الأحمر الدموي .علل.
الجواب : لأنه عند إضافة كلوريد البواتسيوم KCl يختل الاتزان ويزاح موضع الاتزان في اتجاه تكوين المواد المتفاعلة فيقل تركيز Fe (CNS)3 لذلك تقل شدة اللون الأحمر
السؤال : في النظام المتزن التالي : N2 (g) + O2 (g) ⇌ 2NO (g) : لا تتغير قيمة ثابت الاتزان بإضافة المزيد من غاز الأكسجين .
الجواب : لأنه عند إضافة المزيد من الأكسجين يختل الانزان ويزاح موضع الاتزان في الاتجاه الطردي ليقلل من تأثير هذه الزيادة مما يؤدي إلى زيادة تركيز NO ويقلل من تركيز N2 بحيث تبقى النسبة بين تركيزات النواتج و تركيزات المتفاعلات Kaq ثابتة
السؤال : غاز NO2 ( بني محمر ) يوجد في حالة اتزان مع غاز N2O4 ( عديم اللون )حسب المعادلة الحرارية التالية

السؤال : كيف يمكن تفسير اختفاء اللون البني المحمر عند وضع الدورق في مخلوط مبرد
الجواب : عند خفض درجة الحرارة يختل موضع الاتزان حسب مبدأ لوشاتيليه في الاتجاه الطارد للحرارة و هو الاتجاه الطردي فيقل تركيز NO2 البني المحمر ويزداد تركيز N2O4 عدمي اللون وتنشأ حالة اتزان جديدة .
السؤال : للتفاعل السابق كيف يمكن تفسير زيادة شدة اللون البني المحمر عند وضع الدورق في درجة حرارة الغرفة.
الجواب : عند رفع درجة الحرارة يختل موضع الاتزان حسب مبدأ لوشاتيليه في الاتجاه الماص للحرارة و هو الاتجاه العكسي فيقل تركيز N2O4 عدمي اللون ويزداد تركيز NO2 البين المحمر وتنشأ حالة اتزان جديدة
السؤال : في التفاعلات الطاردة للحرارة تقل قيمة ثابت الاتزان برفع درجة الحرارة .علل.
الجواب : عند رفع درجة الحرارة يزاح موضع الاتزان في الاتجاه الماص للحرارة وهو الاتجاه العكسي حيث يزداد تركيز المتفاعلات ويقل تركيز النواتج بالتالي تقل القيمة العددية لثابت الاتزان لأهنا تتغير فقط بتغير درجة الحرارة
السؤال : في التفاعلات الماصة للحرارة تزداد قيمة ثابت الاتزان برفع درجة الحرارة .علل.
الجواب : عند رفع درجة الحرارة يزاح موضع الاتزان في الاتجاه الماص للحرارة وهو الاتجاه الطردي حيث يزداد تركيز النواتج ويقل تركيز المتفاعلات بالتالي تزداد القيمة العددية لثابت االاتزان لأنها تتغير فقط بتغي درجة الحرارة .
في النظام المتزن التالي : N2 (g) + 3 H2 (g) ⇌ 2NH3 (g)
السؤال : يزداد إنتاج الأمونيا عند تقليل حجم الوعاء أو بزيادة الضغط.
الجواب : لأن التفاعل مصحوب بنقص يف الحجم ، أي أن عدد مولات النواتج الغازية أقل من عدد مولات المتفاعلات الغازية لذلك عند زايدة الضغط يزاح موضع الاتزان نحو تكوين المواد ذات عدد المولات الغازية الأقل أي يزاح موضع لاتزان بالاتجاه الطردي مما يزيد من إنتاج الأمونيا.
في النظام المتزن التالي : 2NO2 (g)⇌ N2O4 (g)
السؤال : يزداد انتاج غاز NO2 عند زيادة حجم الوعاء أو بتقليل الضغط .علل.
الجواب : عند زايدة حجم الوعاء يقل الضغط لذلك يزاح موضع الاتزان في اتجاه المواد الغازية ذات الحجم الأكبر أي في اتجاه المواد الناتجة
في النظام المتزن التالي : N2 (g) + O2 (g) ⇌ 2NO (g)
السؤال : لا يتغير موضع الاتزان عند زيادة الضغط على النظام.
الجواب : لأن التفاعل غير مصحوب بتغير في الحجم، أي أن عدد مولات النواتج الغازية يساوي عدد مولات المتفاعلات الغازية لذلك عند زايدة الضغط لا يختل الاتزان ولا يتغير موضع الاتزان
في النظام المتزن التالي : 2NOBr(g) ⇌ Br2 (g) + 2NO (g)
السؤال : يزاح موضع الاتزان في اتجاه تكوين المتفاعالت عند زيادة الضغط المؤثر على النظام.
الجواب : لأن التفاعل مصحوب بزايدة الضغط " تقليل الحجم " على النظام فيختل موضع الاتزان ليزاح في اتجاه الضغط الأقل " عدد المولات الأقل " و هو اتجاه تكوين المتفاعلات وذلك طبقا ملبدأ لوشاتيليه.
السؤال : في التفاعلات الطاردة للحرارة تقل القيمة العددية لثابت الاتزان Keq بزيادة درجة الحرارة. علل.
الجواب : لأنه عند زايدة درجة الحرارة يزاح موضع الاتزان نحو تكوين المتفاعلات " الاتجاه العكسي " وتزداد سرعة التفاعل العكسي و بالتالي يزداد تركيز المتفاعلات و في نفس الوقت يقل تركيز النواتج فتقل القيمة العددية لثابت الاتزان.
السؤال : في التفاعلات الماصة للحرارة تزداد القيمة العددية لثابت الاتزان Keqبزيادة درجة الحرارة. علل.
الجواب : لأنه عند زايدة درجة الحرارة يزاح موضع الاتزان نحو تكوين النواتج " لاتجاه الطردي " وتزداد سرعة التفاعل الطردي و بالتالي يزداد تركيز النواتج و في نفس الوقت يقل تركيز المتفاعلات فتزداد القيمة العددية لثابت الاتزان.
الوحدة الثالثة : الأحماض و القواعد
1- أحماض أرهينيوس : هي مركبات تحتوي على هيدروجين و تـتأين لتعطي كاتيونات الهيدروجين H+ في المحلول المائي
2- قواعد أرهينيوس : هي المركبات التي تتأين لتعطي أنيونات الهيدروكسيد OH في المحلول المائي
3- احماض احادية البروتون : الأحماض التي تحتوي على ذرة هيدروجين واحدة قابلة للتأين
4- أحماض ثنائية البروتون : الاحماض التي تحتوي على ذرتي هيدروجين قابلتين للتأين
5- احماض ثلاثية البروتون : الاحماض التي تحتوي على ثلاث ذرات هيدروجين قابلة للتأين
6- حمض برونستد -لوري : المادة سواء جزيء أو أيون و التي تعطي كاتيون هيدروجين H بروتون في المحلول و تسمى معطي بروتون
7- القاعدة المرافقة : الحمض عندما يفقد بروتون H+
8- قاعدة برونستد - لوري : المادة سواء جزيء أو أيون و التي تستقبل كاتيون هيدروجين H بروتون في المحلول وتسمى مستقبل بروتون
9- الحمض المرافق : القاعدة عندما تستقبل البروتون H الذي فقده الحمض
10- الازواج المترافقة : كل حمض يرفق بقاعدة وكل قاعدة ترفق بحمض
11- المادة المترددة : المادي التي يمكنها ان تسلك كحمض عندما تتفاعل مع القاعدة ، كما يمكنها ان تسلك كقاعدة عندما تتفاعل مع الحمض
12- حمض لويس : الجزيئات أو الأيونات التي لها القدرة على إعطاء زوج من الإلكترونات الحرة لتكون رابطة تساهمية مع جزيئات تسمى الحمض
13- قاعدة لويس : الجزيئات أو الأيونات التي لها القدرة على اعطاء زوج من الإلكترونات الحرة تتكون رابطة تساهمية مع جزيئات اخرى تسمى الحمض
14- أحماض ثنائية العنصر احماض غير اكسجينية : هي الاحماض التي تتكون من هيدروجين H وعنصر أخر A أعلى منه سالبية كهربية
15- الأحماض الاكسجينية : أحماض تتكون من الهيدروجين و الاكسجين وعنصر Xعادة ما يكون لا فلزي وفي بعض الاحيان يكون عنصر فلزي من الفلزات الانتقالية
16- التأين الذاني للماء : هو التفاعل الذي يحدث بيم جزيئي ماء لإنتاج كاتيون هيدرونيوم و أنيون هيدروكسيد
17- ثابت تأين الماء Kw : هو حاصل ضرب تريزي كاتيونات الهيدرونيوم و أنيونات اليهدروكسيد في الماء
18- المحلول المتعادل : هو المحلول الذي يتساوى فيه تركيز كاتيونات اليهدرونيوم و أليونات اليهدروكسيد ويكون مقداره 1 × 10*-7
19-المحلول الحمضي : هو المحلول الذي يكون فيه تركيز كاتيونات الهيدرونيوم أكبر من 1×10-7
20- المحلول القاعدي : هو المحلول الذي يكون فيه تركيز انيونات الهيدروكسيد أكبر من 1×10-7
21- الاس الهيدروجيني PH : هي القيمة السالبة لللوغارتيم العشري لتركيز كاتيون الهيدرونيوم
22- الاس الهيدروكسيدي POH : هي القيمة السالبة لللوغارتيم العشري لتركيز أنيون اليهروكسيد
23- الحمض القوي : هو الحمض الذي يتأين بشكل تام في المحلول المائي و ينتج كميات أكبر من كاتيونات الهيدرونيوم
24- الحمض الضعيف : هو الحمض الذي يتأين جزئيا في محلوله المائي لينتج كميات قليلة من كاتيونات الهيدرونيوم
25- القاعدة القوية : هي القاعدة التي تتأين بشكل تام في محلولها المائي
26- القاعدة الضعيفة : هي القاعدة التي تتأين بشكل جزئي في محلولها المائي لتنتج كميات قليلة من أيونات الهيدروكسيد
27- ثابت تأين الحمض : نسبة حاصل ضرب تركيز القاعدة المرافقة بتركيز كاتيون الهيدرونيوم إلى تركيز الحمض
28- ثابت تأين القاعدة : نسبة حاصل ضرب تركيز الحمض المرافق بتركيز انيون اليهدروكسيد إلى تركيز القاعدة
السؤال : يجب غسل الجلد جيدا بالماء في حال لمس المحاليل القلوية المركزة أو انسكابها. علل.
الجواب : لأن لها خواص كاوية تسبب ألما شديدا وأتكلا للجلد و لايلتئم الجرح الذي تسببه بسرعة.
السؤال : جميع محاليل الأحماض والقواعد توصل الكهرباء بدرجة متفاوتة. علل.
الجواب : لأن المحاليل المائية للأحماض أو القـواعـد تحتوي على إلكتروليتات وقد تكون إلكتروليتات بعض محـالـيـل الأمحاض والقواعد قوية وأخرى ضعيفة.
السؤال : الميثان CH4 لا يعتبر حمضا بالرغم من أنه يحتوي على أربع ذرات هيدروجين .علل.
الجواب : لأن ذرات الهيدروجين الاربع في مركب الميثان CH4 مرتبطة بذرة الكربون H-C بأربعة روابط قطبية ضعيفة بالتالي لا يحتوي الميثان على ذرات هيدروجين قابلة للتأين لذلك لا يعتبر حمضا.
السؤال : حمض الأسيتيك CH3COOH يختلف عن الميثان فعلى الرغم من أنه يحتوي على أربع ذرات هيدروجين إلى أنه يعتبر حمضا أحادي البروتون. علل.
الجواب : لأن هناك ثلاث ذرات متصلة بذرة الكربون بروابط قطبية ضعيفة وبالتالي فهي في قابلة للتأين وهناك ذرة واحدة متصلة بذرة الاكسجين ذات السالبية الكهربائية الكبيرة ولذلك فهي قابلة للتأين CH3-COO8-H8
السؤال : .يعتبر حمض الهيدروكلوريك HCI أو حمض الأسيتيك CH3COOH من أحماض أرهينيوس. علل.
الجواب : لأن هذهالاحماض تحتوي على ذرة هيدروجين قابلة للتأين لتعطي كاتيون الهيدروجين H+في المحلول المائي + Cl + HCl ⇌ H3O
السؤال : يعتبر هيدروكسيد الصوديوم NaOH أو KOH من قواعد أرهينيوس. علل.
الجواب : لأنه يتأين ليعطي أنيونات اليدروكسيد OH- في المحلول المائي NnOH ⇌ Na + OH
السؤال : يعتبر حمض الأسيتيك CH3COOH أو حمض HCI أحماض أحادية البروتون.علل.
الجواب : هذه الأحماض تحتوي على ذرة هيدروجين واحدة قابلة للتأين ويتأين في الماء على مرحلة واحدة.
السؤال : يعتبر حمض الكبريتيك H2SO4 حمض ثنائي البروتون. علل.
الجواب : لأن يحتوي على ذرتيم هيدروجين قابلتين للتأين في الماء على مرحلتين
السؤال : يعتبر حمض الفوسفوريك H3PO4 حمض ثلاثي البروتون. علل.
الجواب : لأنه حمض يحتوي على ثلاث ذرات هيدروجين قابلة للتأين، ويتأين في الماء على ثلاث مراحل
السؤال : يمكن تحضير محلول مركز من هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم. علل.
الجواب : لأنها تذوب كليا في الماء ويكون تركيز أنيون الهيدروكسيد ( OH ) في المحلول كبير جدا لذلك تكون محاليلها مركزة
Na OH ⇌ Na + OH
KOH ⇌ K+ OH
السؤال محاليل هيدروكسيد الكالسيوم وهيدوكسيد المغيسيوم تكون دائما مخففة جدا علل
الجواب : لأن هذه الهيدروكسيدات شحيحة الذوبان في الماء بالتالي يكون انيون الهيدوركسيد OH- في مثل هذه المحاليا منخفضا لذلك محاليلها تكون دائما مخففة جدا
السؤال : يعتبر HCl و HNO3 حمضاً حسب نظرية برونستد - لوري . علل.
الجواب : لأن هذه الاحماض تعطي كاتيون هيدروجين H3O+ في المحلول وتسمى معطى بروتون
السؤال : تعتبر الامونيا NH3 قاعدة حسب نظرية بروتستد - لوري علل
الجواب : لانها مادة نسنقبل كاتيون هيدروجين H+ بروتون في المحلول و تسمى مستقبل بروتون
السؤال : يسلك الماء سلوكا مترددا حسب تعريف برونستد - لورى علل
الجواب : لأن الماء يمكن أن يسلك كمحمض ( يعطي بروتون الهيدروجين ) عندما يتفاعل مع القاعدة كما يمكنه أن يسلك كقاعدة ( يستقبل بروتون اليهدروجين ) عندما بتفاعل مع الحمض H2O+H2O ⇌ H3O+OH
السؤال : تعتبر الامونيا NH3 او CL أو PCl3 قاعدة لويس علل
الجواب : لانه لها قدرة على إعطاء زوج من الإلكترونات الحرة لتكون رابطة تساهمية مع جزيئات أخرى تسمى الحمض
السؤال : يعتبر ثالث فلوريد اليورون BF3 أو ALCL3 حمض لويس علل
الجواب : لأنه له القدرة على استقبال زوج من الإلكترونات الحرة ( من اي قاعدة ) ليكون معها رابطة نساهمية
السؤال : لا يعتبر ثالث فلوريد BF3 من أحماض بروتستد لروي ولكنه يعتبر من أحماض لويس علل
الجواب : لا يتعبر BF3 من أحماض برونستد - لوري لأنه لا يستطيع منح بروتون H+ بينما يعتبر حمض لويس لأنه يستطيع استقبال زوجا من الالكترونات الحرة ( من أي قاعدة ) لتكون معها رابطة تساهمية
السؤال : عند تفاعل كاتيون العيدروجين مع الماء فإن كاتوين الهيدروجين H+ يعتبر حمض لويس و الماء H2O قاعدة لويس علل
الجواب : لان جزيء الماء يعطي زوج الالكترونات الحرة الى كاتيون الهيدروجين الذي يستقبلها ليكونا معا كاتوين الهيدرونيوم H+H2O⇌ H3O
السؤال : في التفاعل التالي : H3N+BF3 ــــــ H3N:BF تعتبر الأمونيا قاعدة لويس ، بينما يعتبر ثالث فلوريد البورون حمض لويس علل.
الجواب : تعتبر الأمونيا NH3 قاعدة لويس لأنها منحت زوجا من الاكترونات الحرة للحمض BF3 لتكون معه رابطة تساهمية بينما BF3 حمض لويس لأنه استقبل زوجا من الالكترونات من القاعدة NH3 لتكون معها رابطة تساهمية
السؤال : لا يوجد كاتيون الهيدروجين بصورة منفردة (حرة) في المحاليل المائية للأحماض.علل.
الجواب : لأنه في الماء او المحلول المائي ترتبط كاتيونات الهيدروجين دائما بجزيئات الماء على شكل كاتوينات هيدرونيوم H3O+
السؤال : الماء النقي يعتبر متعادلا عند جميع درجات الحرارة.علل.
الجواب : لأنه في الماء النقي وعند جميع درجات الحرارة تركيز كاتوين الهيدرونيوم H3O يساوي تركيز انيون الهيدروكسيد OH-
السؤال : محلول غاز كلوريد الهيدروجين في الماء حمضي التأثير علل :
الجواب : لأن غاز كلوريد الهيدروجين يتأين في الماء كليا ليعطي كاتيونات الهيدرونيوم ويكون تركيز كاتيون الهيدرونيوم اكبر من تركيز انيون الهيدروكسيد الناتج الذاتي للماء فيكون المحلول حمضي
2H2O ⇌ H3O+OH
HCL+H2O ــــــــ H3O +CL
السؤال : محلول هيدروكسيد الصوديوم في الماء قاعدي التأثير. علل.
الجواب : لأن هيدروكسيد الصوديوم مادية قاعدية تتأين كليا في المحلول لتعطي أنيونات هيدروكسيد و يكون تركيز كاتيون الهيدرونيوم الناتج من التأين الذاتي للماء أقل من تركيز أنيون الهيدروكسيد فيكون المحلول قاعدي
2H2O ⇌ H3O+OH
NaOH + H2O ـــــــ Na+ OH
السؤال : يعتبر حمض الهيدروكلوريك HCI حمضا قويا، أو لا يوجد ثابت اتزان ( تأين ) في تفاعل تأين الأحماض القوية.
السؤال : في محلول حمض الهيدروكلوريك HCI المخفف يكون تركيز الحمض غير المتأين HCI يساوي صفراً. علل.
الجواب : لأنه يتأين بشكل تام في محلوله المائي حيث يتحول الحمض كليا الى قاعدته المرافقة ويصبح تركيز ا الحمض غير المتأين HCI يساوي صفرا لذلك لا وجود لحالة اتزان في تفاعل تأين الأحماض القوية.
HCL+H2O ــــــــــ H3O+CL
السؤال : يعتبر حمض الأسيتيك CH3COOH حمضاً ضعيفاً. علل.
الجواب : لأنه يتأين جزئيا في محلوله المائي ويشكل حالة اتزان حيث يتحول جزء قليل من الحمض إلى قاعدته المرافقة وكاتيون الهيدرونيوم CH3COOH+ H2O ⇌ H3O+CH3COO
السؤال : الاس الهيدروجيني لمحلول حمض الأسيتيك أكبر من الأس الهيدروجيني لمحلول حمض الهيدروكلوريك
المساوي له بالتركيز. علل.
الجواب : لأن محض الأسيتيك CH3COOH حمض ضعيف يتأين جزئيا في محلوله المائي فيكون تركيز كاتيونات الهيدرونيوم صغيرة في المحلول و تكون قيمة PH له كبيرة أما حمض الهيدروكلوريك HCL حمض قوي يتأين بشكل كامل في محلوله المائي فيصبح تركيز كاتيونات الهيدرونيوم كبير جدا في المحلول قيمة PH له صغيرة أقل
السؤال : يعتبر هيدروكسيد الصوديوم NaOH قاعدة قوية أو لا يوجد ثابت اتزان ( تأين ) في تفاعل تاين القواعد القوية
السؤال : في محلول هيدروكسيد الصوديوم Na OH المخفف يكون تركيز القاعدة غير المتأينو Na OH تساوي صغرا علل
الجواب : لأنه يتأين بشكل تام في محلوله المائي حيث تتحول القاعدة كليا إلى كاتيونات فلزية و أنيونات هيدروكسيد ويصبح تريكز القاعدة غير المتأينة NaOH يساوي صفرا لذلك لا وجود لحالة اتزان في تفاعل تأين القواعد القوية NaOH + H2O ـــــــ Na + OH
السؤال : على الرغم من أي هيدروكسيد الكالسيوم CaOH 2 هيدروكسيد المغنيسيوم MgOH 2 شحيحة الذوبان في الماء إلا أنها قواعد قوية و ليس لها ثابت تأين علل
الجواب : وذلك لأن الكميات الصغيرة التي تذوب في الماء من تلك القواعد تتأين تماما إلى كاتيونات فلزية و أنيونات هيدروكسيد
السؤال : تعتبر الامونيا NH3 قاعدة ضعيفة علل
الجواب : لانها تتأين جزئيا في محاليلها المائية و تشكل حالة اتزان حيث يتحول جزء قليل من القاعدة إلى حمضيها المرافق و أنيون الهيدروكسيد
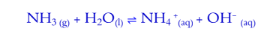
السؤال : الاس الهيدروجيني لمحلول الامونيا أكبر من الاس الهيدروجيني لمحلول هيدروكسيد الصوديوم المساوي له بالتركيز علل :
الجواب :لأن الأمونيا NH3 قاعدة ضعيفة تتأين جزئيا في محلولها المائي فيكون تركيز أنيونات الهيدروكسيد صغيرة في المحلول و تكون قيمة PH له أكبر أما هيدروكسيد الصوديوم NaOH قاعدة قوية تتأين بشكل كامل في محلولها المائي فيصبح تركيز انيونات الهيدروكسيد كبيرجدا في المحلول و تكون قيمة PH له اقل
السؤال : حمض النيتروز 4.4×10-4 ka أقوى من حمض الاسيتيك 1.8 × 10-5 علل
الجواب : لأن ثابت تأين حمض لنيتروز أكبر من ثابت تأين حمض الاسيتيك بالتالي يكون حمض النيتروز أعلى درجة تأين و أكبر قوة من حمض الاسيتيك
السؤال : حمض الفوسفوربك h3po4 له ثلاث ثوابت تأين علل
الجواب : لأن حمض الفوسفوريك حمض ثلاثي البروتون يحتوي على ثلاث ذرات هيدروجين قابلة للتأين على ثلاث مراحل متتالية كل مرحلة لها قيمة ابت تأين Ka
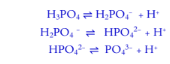
السؤال : حمض الاكساليك H2C2O4 له تابتين تأين ka2 ، kaعلل
الجواب : لان حمض الاكساليك حمض ثنائي البروتون يحتوي على ذرتين هيدروجين قابلتين للتأين على مرحاتين متتاليتين كل مرحلة لها قيمة ثابت تأين Ka
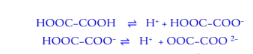
السؤال : حمض الاسيتيك CH3COOH له ثابت تأين واحد Ka علل
السؤال : درجة تأين H3PO4 أكبر من حمض H2PO4 علل
الجواب : لان الحمض في مرحلة التأين الاولى اقوى و ثابت تأين المرحلة الاولى أكبر وبالتالي حمض الفوسفوريك H3PO4 أقوى لأن له ثابت تأين أكبر و بالتالي درجة تأينه أكبر من حمض H2PO4
السؤال : لا يودجد ثابت تأين الاحماض أو القواعد القوية علل
الجواب : لان الاحماض و القواعد القوية تتأين بشكل تام في محاليلها المائية

