مراجعة الاختبار القصير كيمياء للصف الثاني عشر الفصل الثاني اعداد ابراهيم الشهاوي
نقدم لكم مراجعة لمادة الكيمياء الصف الثاني عشر للفصل الدراسي الثاني من إعداد الأستاذ ابراهيم الشهاوي، تتضمن المراجعة ستة أسئلة منوعة مع إجابة قسم منها لمراجعة الاختبار القصير في مادة الكيمياء الثاني عشر الفترة الدراسية الثانية، وهذا المراجعة خاص بمناهج الكويت
مراجعة الاختبار القصير كيمياء للصف الثاني عشر الفصل الثاني اعداد ابراهيم الشهاوي: بإمكانكم تحميل هذا الملف على شكل بي دي أف جاهز للتشغيل على أي جهاز لوحي أو الكتروني أو كمبيوتر عن طريق زر التحميل في الأعلى، كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة.
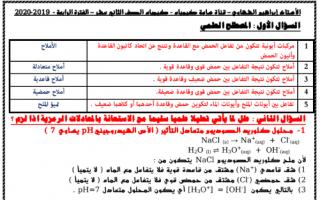
السؤال الأول : المصطلح العلمي
- مركبات أيونية تتكون من تفاعل الحمض مع القاعدة وتنتج عن اتحاد كاتيون القاعدة وأنيون الحمض الأملاح
- أملاح تتكون نتيجة التفاعل بين حمض قوي وقاعدة قوية أملاح متعادلة
- أملاح تتكون نتيجة التفاعل بين حمض ضعيف وقاعدة قوية أملاح قاعدية
- أملاح تتكون نتيجة التفاعل بين حمض قوي وقاعدة ضعيفة أملاح حمضية
- تفاعل بين أيونات الملح وأيونات الماء لتكوين حمض وقاعدة أحدهما أو كلاهما ضعيف تميؤ الملح
السؤال الثاني : علل لما يأتي تعليلا علميا سليما مع الاستعانة بالمعادلات الرمزية اذا لزم ؟
1 - محلول كلوريد الصوديوم متعادل التأثير ( الأس الهيدروجيني pH يساوي 7 )
لأن ملح كلوريد الصوديوم NaCl يتكون من :
1- شق قاعدي +Na مشتق من قاعدة قوية فلا يتفاعل مع الماء ( لا يتميأ )
2- شق حمضي -Cl مشتق من حمض قوي فلا يتفاعل مع الماء ( لا يتميأ )
3- بالتالي يكون [H3O+] = [OH-] أي يكون المحلول متعادل pH = 7
2 - محلول أسيتات الصوديوم CH3COONa قلوي التأثير ( الأس الهيدروجيني pH أكبر 7 )
لأن ملح أسيتات الصوديوم CH3COONa يتكون من :
1- شق قاعدي +Na مشتق من قاعدة قوية فلا يتفاعل مع الماء ( لا يتميأ )
2- شق حمضي -CH3COO مشتق من حمض ضعيف يتفاعل مع الماء ( يتميأ ) ويكون حمض الأسيتيك الضعيف
3- بالتالي يصبح [H3O+] < [OH-] أي يكون المحلول قاعدي pH > 7
3- محلول كلوريد الأمونيوم NH4Cl حمضي التأثير ( الأس الهيدروجيني pH أقل 7 )
لأن ملح كلوريد الأمونيوم NH4Cl يتكون من :
1- شق قاعدي +NH4 مشتق من قاعدة ضعيفة يتفاعل مع الماء ( يتميأ ) ويكون الأمونيا قاعدة ضعيفة
2- شق حمضي -Cl مشتق من حمض قوي فلا يتفاعل مع الماء ( لا يتميأ )
3- بالتالي يصبح [H3O+] > [OH-] أي يكون المحلول حمضي pH < 7
4 - يعتبر كلوريد الصوديوم من الأملاح المتعادلة ( وضح إجابتك بالمعادلات )
ج/ لأنه ينتج من تفاعل حمض قوي وقاعدة قوية
السؤال الثالث : أكمل العبارات التالية :
- محلول فلوريد البوتاسيوم تأثيره …...........…. على الأدلة وذلك بسبب تفاعل أيون ...................…. مع الماء
- الحمض المكون للملح K2S صيغته الكيميائية هي ...............
- إذا تفاعلت كميات متكافئة من KOH مع HCOOH ، فإن المحلول المائي الناتج عنهما .................... التأثير
- قيمه الاس الهيدروجيني pH تكون اكبر من 7 لمحلول أسيتات الصوديوم CH3COONa بسبب تميؤ أيون ..................
- تركيز كاتيونات الهيدروجين H+ في محلول تركيزه 0.1M من كلوريد الصوديوم يساوي ......................... M
- قيمة pH لمحلول كلوريد الأمونيوم ..................... من قيمة pH لمحلول أسيتات الصوديوم والمساوي له في التركيز
السؤال الرابع : ضع علامة ✔ أمام العبارة الصحيحة وعلامة ✖ أمام العبارة غير الصحيحة في كل من الجمل التالية
- ينتج محلول أسه الهيدروجيني يساوي 7 عندما يتفاعل كميات متكافئة من حمض قوي وقاعدة قوية تفاعلا تاما عند 25 C ( )
- ينتج محلول أسه الهيدروجيني أكبر من 7 عندما يتفاعل كميات متكافئة من حمض قوي وقاعدة ضعيفة تفاعلا تاما عند 25 C ( )
- عند إذابة ملح كلوريد البوتاسيوم في الماء النقي ، فإن قيمة الأس الهيدروجيني pH للمحلول تزداد ( )
- صيغه المركب الناتج ن تفاعل حمض النتريك مع ميثيل امين هي CH3NH3+NO3- ( )
- تركيز أيون البوتاسيوم فى محلول مشبع من كرومات البوتاسيوم K2Cro4 يساوى ضعف تركيز المحلول المشبع من كرومات البوتاسيوم ( )
السؤال الخامس :اختر الإجابة الصحيحة :
4 - المحلول الذى له أكبر قيمة pH من بين المحاليل التالية المتساوية فى التركيز هو محلول من :
كبريتات النحاس II - نيترات الالومنيوم - فورمات البوتاسيوم - نترات البوتاسيوم
5 - عند إضافة لتر من حمض الفورميك الى لتر من محلول NaOH المساوي له في التركيز تكون قيمة pH للمحلول الناتج:
7 - 5 - أقل من 7 - أكبر من 7
6 - أحد قيم pH التالية تمثل نقطة التكافؤ المتوقعة عند معايرة محلولي الأمونيا وحمض الهيدروكلوريك هي :
7 - 8.3 - 5.6 - 10
7- عند إضافة لتر من محلول حمض الأسيتيك الى لتر من محلول الامونيا المساوي له في التركيز فإن قيمة الاس الهيدروجيني pH للمحلول الناتج تساوى:
7 - 5 - أقل من 7 - أكبر من 7
8 - المحلول الذى له أكبر قيمة pH من بين المحاليل التالية التي لها نفس التركيز:
NH4Cl - K2SO4 - NaF - NH4NO3
9 - لا يحدث تميؤ عند إذابة أحد الأملاح التالية في الماء وهو:
Na2CO3 - Na2SO4 - NaCN - NH4NO3
10 - يمكن الحصول على محلول قيمة pH له تساوى 7 وذلك عند خلط كميات متكافئة من المحاليل التالية:
حمض الهيدروكلوريك ومحلول الأمونيا. - حمض الأسيتيك و هيدروكسيد الصوديوم - حمض الهيدروكلوريك و هيدروكسيد الصوديوم. - حمض الأسيتيك و محلول الأمونيا
11 - أحد الأملاح التالية يذوب في الماء ومحلوله يزرق ورقة تباع الشمس :
نيترات الصوديوم - كلوريد الأمونيوم - كربونات البوتاسيوم - كلوريد الألومنيوم
13- المحلول المائي لملح كلوريد الحديد FeCl3 III حمضي ويرجع ذلك الى تفاعل:
- أنيون Cl- مع الماء مما يجعل المحلول غنيا بكاتيونات H+
- أنيون Cl- مع الماء مما يجعل المحلول غنيا بأنيونات OH-
- كاتيون Fe+3 مع الماء مما يجعل المحلول غنيا بأنيونات OH-
- كاتيون Fe+3 مع الماء مما يجعل المحلول غنيا بكاتيونات H+
15 - اذا كانت قيمة الأس الهيدروجيني pH لمحلول سيانيد الأمونيوم أكبر من 7 وقيمة pH لمحلول أسيتات الأمونيوم تساوى 7 فإن :
حمض الأسيتيك أقوى من حمض الهيدروسيانيك - حمض الأسيتيك أضعف من حمض الهيدروسيانيك - لا يحدث تميؤ لأنيون الأسيتات في المحلول - لا يحدث تميؤ لأنيون السيانيد في المحلول
16 - يتكون ملح كبريتيت الأمونيوم عند تفاعل كميات متكافئة من :
حمض الكربونيك مع محلول الأمونيا - حمض هيروكبريتيك مع محلول الامونيا - حمض الكبريتيك مع محلول الأمونيا - حمض الكبريتوز مع محلول الامونيا
17 - عند ذوبان ملح أسيتات الصودي وم في الماء فإن العبارة غير الصحيحة :
- لا يتميأ كاتيون الصوديوم Na+ لأنه يشتق من قاعدة قوية
- يزداد تركيز أنيون الهيدروكسيد في المحلول ويصُبح المحلول قلوياً
- تركيز أنيون الأسيتات ب المحلول يساوي تركيز كاتيون الصوديوم
- يتميأ أنيون الأسيتات بشكل محدود لينتج حمض الأسيتيك وأنيون الهيدروكسيد
18 - المحلول المائي لسيانيد البوتاسيوم KCN قلوي التأثير ويرجع ذلك لتفاعل :
- كاتيونات البوتاسيوم في الماء مما يجعل المحلول غنيا بأيونات OH-
- كاتيونات البوتاسيوم مع الماء مما يجعل المحلول غنيا بأيونات H3O+
- أنيونات السيانيد مع الماء مما يجعل المحلول غنيا بأيونات OH-
- أنيونات السيانيد مع الماء مما يجعل المحلول غنيا بأيونات H3O+