مذكرة الاختبار القصير 2 كيمياء للصف الثاني عشر الفصل الثاني
نقدم لكم مذكرة لمادة الكيمياء الصف الثاني عشر للفصل الدراسي الثاني، تتضمن المذكرة مراجعة في الكيمياء العضوية للهيدروكربونات الهالوجينية والكحولات في مادة الكيمياء الثاني عشر الفترة الدراسية الثانية، وهذه المذكرة خاصة بمناهج الكويت
مذكرة الاختبار القصير 2 كيمياء للصف الثاني عشر الفصل الثاني: بإمكانكم تحميل هذا الملف على شكل بي دي أف جاهز للتشغيل على أي جهاز لوحي أو الكتروني أو كمبيوتر عن طريق زر التحميل في الأعلى، كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة.
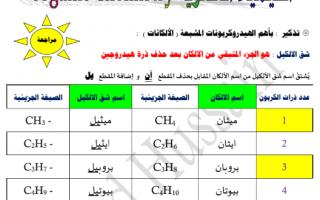
الخواص الفيزيائية للهيدروكربونات الهالوجينية :
1- الهيدروكربونات الهالوجينية شحيحة الذوبان في الماء على الرغم من أنها مركبات قطبية علل :
لعدم قدرتها على تكوين روابط هيدروجينية بين جزيناتها وجزنيات الماء
2- درجة غليان هاليدات الألكيل أعلى بكثير من درجات غليان الألكانات التي حضرت منها علل :
لأن هاليدات الألكيل مركبات قطبية وقوى التجاذب بين جزئياتها كبيرة بينما الألكانات مركبات غير قطبية مثال : درجة غليان CH3 - Cl أعلى من درجة غليان CH4
3- تزداد درجة غليان هاليدات الألكيل التي تحتوي على ذرة الهالوجين نفسها بزيادة كتلتها الجزيئية مثال : درجة غليان بروميد الايثيل CH3-CH2-Br أعلى من بروميد الميثيل CH3-Br ( علل )
لأن الكتلة الجزيئية لشق الإيثيل أكبر من الكتلة الجزيئية لشق الميثيل
4- تزداد درجة غليان هاليدات الألكيل التي تحتوي على المجموعة العضوية نفسها بزيادة الكتلة الجزيئية لذرة الهالوجين
لأن الكتلة الجزيئية لليود أكبر من الكتلة الجزيئية للبروم
5- تتميز مركبات البروم و اليود بكثافة أعلى من كثافة الماء
رتب الهيدروكربونات الهالوجينية التالية تصاعديا بحسب درجات غليانها :
الخواص الكيميائية للهيدروكربونات الهالوجينية (التفاعلات) :
تعتبر هاليدات الألكيل مواد نشطة غير مستقرة تتفاعل بسهولة علل:
لأن ذرة الهالوجين لها سالبيه كهربائية عالية مما يؤدي الى قطبية الرابطة حيث تحمل ذرة الهالوجين شحنة سالبة جزئية وتحمل ذرة الكربون شحنة موجبة جزئية
ملاحظة : تتفاعل هاليدات الألكيل إما بالاستبدال أو بالانتزاع وسنكتفي فقط بتفاعلات الاستبدال:
تفاعل هاليدات الألكيل بالاستبدال :
حيث يتم خروج أيون ذرة الهالوجين السالب (X) ويحل محله أنيون أخر مثل أنيون الهيدروكسيد OH أو أنيون الكوكسيد (OR) أو أنيون الأميد (NH2 ) وتكون هذه الأنيونات متصلة بالصوديوم أو البوتاسيوم ليسهل تأينها
استخدامات مركبات الهيدروكربونات الهالوجينية :
- يستخدم كلوريد الفينيل في تحضير مادة (PVC ) المستخدمة في صنع الأنابيب والعوازل
- يستخدم الكلوروفورم CHCl3 كمخدر في مجال الطب حيث كان له أثر كبير في تقدم الجراحة الطبية
- يستخدم رابع كلوريد الكربون CCl4 في صنع مركبات الكلورفلوروکربون CFCI المستخدمة كعامل تبريد في الثلاجات وأجهزة التكييف . وكغازات دفع في علب رش المبيدات الحشرية ومصففات الشعر ومعاجين الحلاقة
- يستخدم الهالوثان (2 - برومو 2 - کلورو 1 ، 1 ، 1 - ثلاثي فلورو الايثان ) كمخدر في مجال الطب
الكحولات
تسمية الكحولات ذات السلاسل المستقيمة ( بحسب نظام الأيوباك )
- نحدد أطول سلسلة كربونية متصلة تحتوي على مجموعة ( OH-)
- نرقم السلسلة من الطرف الأقرب لمجموعة ( OH- )
- رقم ذرة الكربون المتصلة بمجموعة ( OH- ) + اسم الألكان + المقطع ول
تصنيف الكحولات تبعا لعدد مجموعات الهيدروكسيل :
- كحولات أحادية الهيدروكسيل هي الكحولات التي تتميز بوجود مجموعة هیدروکسیل واحدة في الجري
- كحولات ثنائية الهيدروكسيل هي الكحولات التي تتميز بوجود مجموعتين هیدروکسیل واحدة في الجرئ
- كحولات عديدة الهيدروكسيل هي الكحولات التي تتميز بوجود ثلاث مجموعات هیدروکسیل ( أو أكثر ) في الجزئ
تصنيف الكحولات تبعا لنوع ذرة الكربون المرتبطة بمجموعة الهيدروكسيل -OH :
- كحولات أولية هي الكحولات التي ترتبط فيها مجموعة الهيدروكسیل بذرة كربون أولية متصلة بذرتي هيدروجين و مجموعة ألكيل أو بذرات هيدروجين
- كحولات ثانوية هي الكحولات التي ترتبط فيها مجموعة الهيدروکسيل بذرة كربون (ثانوية) متصلة بذرة هيدروجين و مجموعتي ألكيل
- کحولات ثالثية هي الكحولات التي ترتبط فيها مجموعة الهيدروكسیل بذرة كربون ثالثية متصلة بثلاث مجموعات الكيل
تحضير الكحولات
1) إماهة الألكينات ( إضافة الماء إلى الألكينات ) :.
يتم ذلك في وجود وسط حمضي مثل ( حمض الكبريتيك المخفف H2SO4 أو حمض الفوسفوريك H3PO4 )
ويعتمد نوع الكحول الناتج على تماثل الألكين ( تبعا لقاعدة ماركينوكوف )
(عند اضافة جزئ فيه هيدروجين على ألكين ، تتم إضافة الهيدروجين الى الكربون المرتبط بالعدد الأكبر من ذرات الهيدروجين و النصف الثاني من الجزئ الى الكربون المرتبط بالعدد الأقل من ذرات الهيدروجين )
2) تميؤ هاليدات الألكيل ( التحلل المائي )
يتم ذلك في وجود مادة قلوية مثل ( NaOH مع التسخين )
الخواص الفيزيائية للكحولات
1- علل : درجة غليان الكحولات أعلى من درجة غليان الهيدروكربونات المقاربة لها في الكتلة
لأن الكحولات تحتوي مجموعات الهيدروكسيل القطبية التي تعمل على تكوين الروابط الهيدروجينية بين جزيئاتها ، بينما الهيدروكربونات مركبات غير قطبية و قوة التجاذب بين جزيئاتها ضعيفة
2- تزداد درجات غليان الكحولات غير المتفرعة والتي تحتوي على عدد مجموعات الهيدروكسيل نفسها بزيادة الكتلة المولية
3- علل : تزداد درجة غليان الكحولات بزيادة عدد مجموعات الهيدروكسيل في الجزئ
لزيادة عدد الروابط الهيدروجينية التي يمكن للجري أن يكونها مع جزيئات كحول أخرى
4- علل : درجة غليان الجليكول ايثيلين أكبر من درجة غليان الميثانول
لأنه يحتوي على مجموعتين هيدروكسيل بينما الميثانول يحتوي على مجموعة هيدروكسيل واحدة و بالتالي يكون الجليكول ايثيلين روابط هيدروجينية أكثر بين جزيئاته
5- علل : تذوب الكحولات ذات الكتل المولية المنخفضة و التي تحتوى على ذرة كربون أو ذرتين أو ثلاث ذرات بسهولة في الماء
بسبب قدرتها على تكوين روابط هيدروجينية مع جزيئات الماء
6- علل : تقل الذوبانية في الماء بزيادة الكتلة المولية أي ( بزيادة طول السلسلة الكربونية )
لأن طول السلسلة الكربونية يقلل من قطبية مجموعة الهيدروكسيل وبذلك لا تستطيع تكوين روابط هيدروجينية مع الماء
7- علل : تزداد ذوبانية الكحولات في الماء مع زيادة عدد مجموعات الهيدروكسيل في الجزئ
بسبب زيادة عدد الروابط الهيدروجينية التي يمكن للجري أن يكونها مع جزئيات الماء
املا الفراغات في الجمل و المعادلات التالية بما يناسبها :
1) الصيغة البنائية المكثفة لمركب بروميد أيزوبيوتيل هي .........................
2) الصيغة الكيميائية للمركب العضوية الناتج من تفاعل مع الايثان في وجود UV هي .........................
3) درجة غليان بروميد الميثيل ......................... درجة غليان كلوريد الميثيل
4) الصيغة العامة لهاليد الألكيل الثانوي هي ..................
5) يتفاعل 1 - برومو بروبان مع محلول هيدروكسيد الصوديوم ، و ينتج مركب عضوي صيغته ...................... الذي يسخن مع حمض الكبريتيك المركز لدرجة C° 180 لينتج مركب عضوي يسمى ..........................
8) يتفاعل كلوريد أيزوبروبيل مع أميد الصوديوم و ينتج كلوريد الصوديوم و مركب صيغته ..................
علل لكل مما يلي:
1- يعتبر المركب 2- برومو بيوتان من هاليدات الألكيل الثانوية
2- لا يمكن استخدام طريقة اللجنة المباشرة للالكانات للحصول على هاليدات الألكيل النقية
3- الهيدروكربونات الهالوجينية شحيحة الذوبان في الماء على الرغم من أنها قطبية
4- درجة غليان هاليدات الألكيل أعلى بكثير من درجات غليان الالكانات التي حضرت منها
5- درجة غليان CH3 - CH2 - CH2 - Br أعلى من درجة غليان CH3 - CH2 - Br
6- درجة غليان يوديد الإيثيل أعلى من درجة غليان كلوريد الايثيل
7- تعتبر هاليدات الألكيل مواد نشطة غير مستقرة تتفاعل بسهولة
8- لا يعتبر الفينول من الكحولات على الرغم من احتوائه على مجموعة الهيدروكسيل