المصطلحات العلمية كيمياء الصف الثاني عشر الفصل الثاني: يتضمن هذا الملف أهم المصطلحات العلمية وشروحاتها بالإضافة للعديد من التعاليل المهمة في مادة الكيمياء الصف الثاني عشر علمي ، تم وضع الملف ومحتواه من قبل مدرس متخصص بتدريس المادة.المصطلحات العلمية كيمياء الصف الثاني عشر الفصل الثاني:بإمكانكم تحميل هذا الملف على شكل بي دي أف جاهز للتشغيل على أي جهاز لوحي أو الكتروني أو كمبيوتر كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة.
أهم المصطلحات العلمية من منهج الكيمياء فصل ثاني:
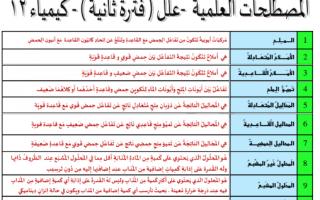
1- الملح: مركبات أيونية تتكون من تفاعل الحمض مع القاعدة وتنتج من اتحاد كاتيون القاعدة مع أنيون الحمض.
2- الأملاح المتعادلة: هي أملاح تتكون نتيجة التفاعل بين حمض قوي وقاعدة قوية.
3- الأملاح القاعدية: هي أملاح تتكون نتيجة التفاعل بين حمض ضعيف وقاعدة قوية.
4– تميؤ الملح: تفاعل بين أيونات الملح وأيونات الماء لتكوين حمض وقاعدة احدهما او كلاهما ضعيف
5- المحاليل المتعادلة: هي المحاليل الناتجة عن ذوبان ملح متعادل ناتج عن تفاعل حمض قوي مع قاعدة قوية.
6- المحاليل القاعدية: هي المحاليل الناتجة عن تميؤ ملح قاعدي ناتج عن تفاعل حمض ضعيف مع قاعدة قوية.
7- المحاليل الحمضية: هي المحاليل الناتجة عن تميؤ ملح حمضي ناتج عن تفاعل حمض قوي مع قاعدة ضعيفة.
8- المحلول غير المشبع: هي المحلول الذي يحتوي على كمية من المادة المذابة أقل مما في المحلول المشبع عند الظروف ذاتها وله القدرة على إذابة كميات إضافية من المذاب عند إضافتها إله من دون ترسيب.
9- المحلول المشبع: هو المحلول الذي يحتوي على أكبر كمية من المذاب وليس له القدرة على إذابة أي كمية إضافية من المذاب فيه عند درجة حرارة معينة. بحيث تترسب أي كمية إضافية من المذاب ويكون في حالة إتزان ديناميكي.
10- المحلول فوق المشبع: هو المحلول الذي يحتوي على كمية من المادة المذابة أكبر مما في المحلول المشبع عند الظروف ذاتها.
11- الذوبانية: هي كمية المذاب اللازمة لتكوين محلول مشبع متزن في كمية محددة من المذيب وعند درجة حرارة معينة.
12-حالة الإتزان الديناميكي: هي الحالة التي يكون فيها معدل ذوبان المذاب مساوياً تماماً لمعدل ترسبه.
13- الأملاح القابلة للذوبان: هي أملاح تذوب كمية كبيرة منها في الماء قبل أن يتكون راسب الملح.
14- الَأمَلاحُ غَيَرُ القَابِلة للذَوبَانِ: هي أملاح تذوب كمية قليلة جداً منها في الماء وتسمى احياناً بالأملاح شحيحة الذوبان.
15- ثابت حاصل الإذابة (K(sp: هو حاصل ضرب تركيز الأيونات مقدراً بالمول/لتر والتي تتواجد في حالة اتزان في محلولها المشبع كل مرفوع إلى الأس الذي يمثل عدد مولات (معاملات) الأيونات الموجودة في معادلة التفكك الموزونة عند درجة حرارة معينة.
16- الحاصل الأيوني (Q): حاصل ضرب تركيزات الأيونات الموجودة في المحلول ( سواء كان غير مشبع أو مشبع أو فوق المشبع) كل مرفوع إلى أس يساوي عدد مولاته في الصيغة.
17- المحاليل المنظمة: هو المحلول الذي يقاوم التغير المفاجئ في الأس الهيدروجيني PH للوسط عند إضافة كميات قليلة من حمض كاتيونات أو قاعدة أنيونات إليه.
18- المعايرة: هي عملية تستخدم لتقدير تركيز مادة معينة في محلول ما بواسطة محلول آخر معلوم التركيز يسمى المحلول القياسي.
19- تفاعل التعادل: هو تفاعل كاتيون الهيدرونيوم من الحمض مع أنيون الهيدروكسيد من القاعدة لتكوين الماء 20- المحلول القياسي: هو المحلول المعلوم تركيزه بدقة.
21- الدليل المناسب: هو الدليل الذي يجب أن يتغير لونه عند حدوث التغير المفاجئ في قيمة الأس الهيدروجيني PH للمحلول حول نقطة تكافؤ.
22- منحني المعايرة: هو منحني يمثل العلاقة البيانية بين الأس الهيدروجيني PH للمحلول في الدورق المخروطي و حجم الحمض أو القاعدة المضاف من السحاحة في معايرة الأحماض والقواعد.
23-نقطة التكافؤ: هي النقطة التي يتساوى فيها عدد مولات القاعدة المضافة (أحادية الهيدروكسيد) مع عدد مولات الحمض الموجود في الكأس الموجود في الكأس خلال المعايرة (حمض أحادي البروتون).
24- المجموعة الوظيفية: عبارة عن ذرة أو مجموعة ذرية تمثل الجزء النشط الذي ترتكز إله التفاعلات الكيميائية للمركب الذي يحتويها و تحدد الصيغة البنائية والخواص الكيميائية لعائلة من المركبات العضوية.
25- تفاعلات الاستبدال: هي تفاعلات تحل فيها ذرة أو مجموعة ذرية محل ذرة أو مجموعة ذرية أخرى متصلةُ بذرة الكربون.
26- تفاعلات الانتزاع: هي تفاعلات يتم فيها نزع ذرتين أو ذرة ومجموعة ذرية من ذرتي كربون متجاورتين لتكوينُ مركباتُ غيرُ مشبعة.
27- تفاعلات الإضافة: هي تفاعلات يتم فيها إضافة ذرات أو مجموعات ذرية من ذرتي كربون متجاورتينُ ُترتبطان ُبرابطةُتساهميةُ ُثنائيةُ أوُ ثلاثية ُغير ُمشبعةُ.
28- الهيدروكربونية الهالوجينية : مركبات عضوية مشتقة من الهيدروكربونات الاليفاتية أو الأروماتية باستبدال ذرة هالوجين أو ُأكثرُ محل ما يماثل عددها من ذراتا لهيدروجين.
29- هاليد الألكيل ( هالو ألكان): هو مركب هيدروكربوني تتصل فيه ذرة هالوجين واحده بشقُ ألكيلُ واحدُ فقطُ.
30- هاليد الفينيل ( هالو بنزين ): هو مركب هيدروكربونيُ ُتتصل فيه ذرة هالوجين واحده بشق فينيل "أريل".
31- شق الألكيل R: هو الجزء المتبقي من الألكان بعد نزع ذرة هيدروجين واحدة فقط منه.
32- شق الفينيل أو الأريل Ar : هو الجزء المتبقي من حلقة البنزين بعد نزع ذرة هيدروجين واحدة منه.
33- الكحولات: هي مركبات عضوية تتميز باحتوائها على مجموعة هيدروكسيل ( -OH ) أوُ أكثرُ مرتبطة بذرة كربون مشبعة.
34- الفينولات:عائلة من المركبات العضوية فيها ترتبط مجموعة الهيدروكسيل مباشرة ُبحلقةُ البنزين.
35- الكحولات الألفانية المشبعة: هي ُالكحولات التي تحتوي جزيئاتها على سلسلة كربونية أليفاتيه.
36- الكحولات الأروماتية: هي الكحولات التي تحتوي بمجموعة الهيدروكسيل جزيئاتها على حلقة بنزين لا تتصل مباشرة بمجموعة الهيدروكسيل.
37- كحولات أحادية الهيدروكسيل: هي الكحولات التي تتميز بوجود مجموعة هيدروكسيل واحدة في الجزئ.
38- كحولات ثنائية الهيدروكسيل: هي ُالكحولات التي تتميز بوجود مجموعتي من الهيدروكسيل في الجزئ.
39- كحولات عديدة الهيدروكسيل: هي ُالكحولات التي تتميز بوجود ثلاث مجموعات هيدروكسيل أو أكثر في الجزئ.
40- قاعدة ماركينوكوف: عند إضافة جزئ فيه هيدروجين على ألكين ,ُتتم إضافة الهيدروجين إلى الكربون المرتبط بالعدد الأكبر من ذرات الهيدروجين والنصف الثاني من الجزئ إلى الكربون المرتبط بالعدد الاقل من ذرات الهيدروجين.
41- تــــفــــاعــــلات الأســــتــــرة (تكوين الإستر ): هو ُتفاعل الكحول مع الحمض الكربوكسيلي لتكوينُ الإسترُ والماء.
أهم التعاليل كيمياء الصف الثاني عشر العلمي:
علل ما يلي :
1- لا يشكل الماء المقطر محلولاً منظماً.
لأنه لا يقاوم التغير المفاجئ في قيمة pH عند إضافة كمية قليلة من حمض قوي أو قاعدة قويه.
2- تحتوي العصارة المعدية في جسم الإنسان على محاليل منظمة حمضية لها pH يساوي 1.4 وُ هي تقارن بحمضية محلول من حمض الهيدروكلوريك.
لأن هذه الحمضية العالية مهمة جداً في عملية تحلل البروتينات لأن جزيئاتها كبيرة ولا يمكن لجدران الأمعاء امتصاصها.
3- لا يصلح الميثيل البرتقالي كدليل عند معايرة محلول لحمض الاسيتيك مع هيدروكسيد البوتاسيوم
لأن حمض الأستيتك حمض ضعيف و هيدروكسيد البوتاسيوم قاعدة قوية بالتالي ستكون قيمة pH عند نقطة التكافؤ أكـــبــــــر من 7 في حين أن مدى دليل الميثيل البرتقالي أقــــــل من 7
4- الهيدروكربونات الهالوجينية شحيحة الذوبان في المء على الرغم من أنها مركبات قطبية.
لعدم قدرتها على تكوين روابط هيدروجينية بين جزيئاتها وجزئيات الماء.
5- درجة غليان هاليدات الألكيل أعلى بكثير من درجات غليان الالكانات التي حضرت ُمنها.
لأن هاليدات الألكيل مركبات قطبية وقوى التجاذب بني جزئياتها كبيرة بينما الألكانات مركبات غير قطبية
6- درجة غليان الكحولات أعلى من درجة غليان الهيدروكربونات المقاربة لها في الكتلة
لأن الكحولات تحتوي مجموعات الهيدروكسيل القطبية التي تعمل على تكوين الروابط الهيدروجينية بين جزيئاتها , بينما الهيدروكربونات مركبات غير قطبية و قوة التجاذب بين جزيئاتها ضعيفة.
7-تزداد درجة غليان الكحولات بزيادة عدد مجموعات الهيدروكسيل في الجزئ .
زيادة عدد الروابط الهيدروجينية التي يمكن للجزئ أن يكونها مع جزيئات كحول أخرى.
8-تذوب الكحولات ذات الكتل المولية المنخفضة والتي تحتوي علة ذرة كربون أو ذرتين أو ثلاث ذرات بسهولة في الماء.
بسبب قدرتها على تكوين روابط هيدروجينية مع جزيئات الماء.
9- تقل الذوبانية في الماء بزيادة الكتلة المولية أي ( بزيادة طول السلسة الكربونية).
لأن طول السلسلة الكربونية يقلل من قطبية مجموعة الهيدروكسيل وبذلك لا تستطيع تكوين روابط هيدروجينية مع الماء.