الالكترونات في الذرات والدورية الكيميائية
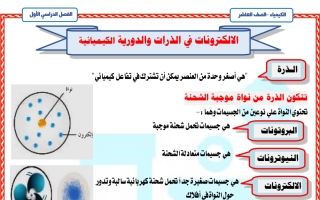
الذرة
" هي أصغر وحدة من العنصر يمكن أن تشترك في تفاعل كيميائي"
تتكون الذرة من نواة موجبة الشحنة
تحتوي النواة علي نوعين من الجسيمات وهما : -
البروتونات
هي جسيمات تحمل شحنة موجبة
النيوترونات
هي جسيمات متعادلة الشحنة
الالكترونات
. هي جسيمات صغيرة جدا تحمل شحنة كهربائية سالبة وتدور حول النواة في أفلاك
وتحتوي النواة على أكثر من 99% من كتلة الذرة
تطور النماذج الذرية
نموذج رذرفورد
قام رذرفورد يارسال سيل من جسيمات ألفا الموجبة الشحنة على شريحة رقيقة من الذهب. وبعد ها افترض ما يلي :-
1- تشبه الذرة المجموعة الشمسية ( تدور الإلكترونات سالبة الشحنة حول نواة مركزية).
2- معظم الذرة فراغ ، وحجم النواة صغير جداً بالنسبة إلى حجم الذرة.
3- تتركز كتلة الذرة في النوة ( لأن كتلة الإلكترونات صغيرة جداً مقارنة بكتلة مكوّنات النواة من البروتونات والنيوترونات) .
4- يوجد في الذرة نوعان من الشحنات ( شحنة موجبة في النواة تدعى بروتونات وشحنة سالبة حول النواة تدعى إلكترونات)
5- الذرة متعادلة كهربائيًا لأنّ عدد الشحنات الموجبة يساوي عد الشحنات السالبة.
6- تدور الإلكترونات حول النواة في مدارات خاصة.
حين يدور الإلكترون حول النواة ، يخضع لقوتين الأولى قوة جذبها للإلكترونات والأخرى قوة الطرد المركزي الناشئة عن دوران الإلكترونات حول النواة.
نموذج بور
استخدم بور نموذج ذرة الهيدروجين
1- يدور الإلكترون حول النواة في مدار ثابت .
2- للذرة عدد من المدارات تسمى ( مستويات الطاقة ) يشار إليها بالحرف (n)
لكل منها نصف قطر ثابت وطاقة محددة .
3- لا يشع الإلكترون الطاقة ولا يمتصها ما دام يدور في المسار نفسه حول النواة .
4- يمكن للإلكترون أن ينتقل من مستوى إلى مستوى آخر عندما يأخذ طاقة لينتقل إلى مستوى أعلى بينما يشع طاقة إذا انتقل إلى مستوى أقل فينتج طيف الإشعاع الخطي .
النموذج الميكانيكي الموجي للذرة
نموذج شرودنجر
يوضح طبيعة حركة الإلكترونات حول النواة معتمداً على طبيعته الموجية
علل : يصعب تحديد موقع الالكترون بدقة حول النواة.
ج / بسبب الحركة الموجية للالكترون حول النواة وسرعته العالية جداً
الفلك الذري
هو المنطقة الفراغية حول النواة والتي يكون فيها أكبر احتمال لوجود الإلكترون"
كم الطاقة
الأعلى التالي له "
هو كمية الطاقة اللازمة لنقل الإلكترون من مستوى الطاقة الساكن فيه إلى مستوى الطاقة
اختر الإجابة الصحيحة:
. إذا كانت قيمة ( n ) =2 وقيمة (1) - 1 فإن ذلك يعني تحت المستوى : -
4s
3s
2s
2s
. إذا كانت قيمة ( n ) = 3 وقيمة (1) - فإن ذلك يعني تحت المستوى :-
2d
3d
3p
3s
إذا كانت قيمة (n) = 4 وقيمة (L) - فإن ذلك يعني تحت المستوى : -
4s
4d
4p
5s
.الفلك ( S )
شكل الأفلاك
فلك كروي الشكل واتجاه محتمل واحد ويكون احتمال وجود الإلكترون في أي اتجاه من النواة متساوياً
الأفلاك ( P )
1 - الكثافة الإلكترونية حول كل فلك منها تأخذ شكل فصين متقابلين عند الرأس
2- يتكون تحت المستوى P من ثلاثة أفلاك متساوية الطاقة
3- تختلف عن بعضها بالاتجاهات التي تتركز فيها السحابة الالكترونية فقط .
4- تقع هذه الاتجاهات على زاوية قائمة من بعضها البعض
أفلاك تحت المستوى p متماثلة في جميع ما يلي ، عدا واحداً
الطاقة
الاتجاه الفراغي
شكل
الملء الالكتروني
الشكل
4- عدد الكم المغزلي ( ms )
يحدد نوع حركة الإلكترون المغزلية حول محورة أثناء دورانه حول النواة
ويأخذ القيم ( 1/2 - أو 12 + )
علل
لا يتنافر الالكترونان في الفلك نفسه رغم أن شحنتيهما سالبة
أو يتسع الفلك الواحد لإلكترونين فقط
يتسع الفلك الواحد لأكثر من الكترونين
نتيجة دوران الإلكترونين حول محوريهما في الفلك نفسه باتجاهين متعاكسين, ينشأ مجالا مغناطيسيان متعاكسان في الاتجاه فيتجاذبان مغناطيسياً مما يقلل من التنافر بينهما
أجب عن الأسئلة التالية
. أكمل الفراغات التالية .
1 - ينقسم تحت المستوى p الى 3 أفلاك بينما تحت المستوى d ينقسم الى 5 أفلاك
2- تتركز معظم كتلة الذرة في النواة
3 - يحدد عدد الكم الرئيسي مستويات الطاقة . بينما يحدد عدد الكم الثانوي. تحت مستويات الطاقة ..
4- يحدد عدد الكم المغزلي. . اتجاه دوران الالكترون حول محوره. ويأخذ القيم +1/2 او 1/2
7- الفلك الوحيد لتحت المستوى (S) له شكل. كروي.
8- كلما زادت القيمة العددية لعدد الكم ( n) دل ذلك على زيادة . طاقة. الإلكترون و بعده عن النواة
9- عدد الكم الذي يدل على الاتجاه الذي يسلكه الإلكترون عند دورانه حول محوره يسمى .. المغزلي
علل : " يتسع تحت المستوى (d) لعشرة إلكترونات فقط .
ج/ لأنه يحتوي على خمسة أفلاك وكل فلك يتسع لإلكترونين.
• علل : لا يتسع مستوى الطاقة الرئيسي الثاني لأكثر من ثمانية إلكترونات فقط .
ج/ لأنه يحتوي على تحت مستويين s, p وتحت المستوى 5 يحتوي على فلك واحد وتحت المستوى p يحتوى على ثلاثة أفلاك وكل فلك يتسع لإلكترونين.
الترتيب الالكتروني :
" هي الطريقة التي تترتب بها الالكترونات حول أنويه الذرات
قواعد ترتيب الالكترونات في الذرات :-
1 - مبدأ أوفباو: (مبدأ البناء التصاعدي) :
• لابد للالكترونات أن تملأ تحت مستويات الطاقة ذات الطاقة المنخفضة أولاً ثم تحت مستويات الطاقة ذات الطاقة الأعلى .
لذلك تترتب الالكترونات فى تحت المستويات على النحو التالى
15 / 25 - 2P/ 35 - 3P / 4S - 3d - 4P
3 - قاعدة هوند
" الالكترونات تملأ أفلاك تحت مستوى الطاقة الواحد, كل واحدة بمفردها باتجاه الغزل نفسه, ثم تبدأ بالازدواج في الأفلاك تباعاً باتجاه غزل معاكس "
ملحوظة:
يتسع كل فلك لإلكترونين يكون دورانهما المغزلي في اتجاهين