انفوجرافيك المادة علوم ثامن فصل أول #أ. موضي السبيعي
المادة
هو كل ماله كتلة ويشغل حيزاً من الوسط.
كل شي من حولنا يتكون من مادة
تتكون المادة منوحدات صغيرة جدًا لايمكن رؤيتها بالعين المجردة تسمى بـ الجزيئات
المادة توجد في ثلاث حالات :
| الحالة الصلبة | الحالة الغازية | الحالة السائلة | |
| نوع الحركة | اهتزازية | انتقالية عشوائية | انتقالية |
| الحجم | ثابت | متغير | ثابت |
| الشكل | ثابت | متغير | متغير |
| الترابط | جزيئاتها مترابطة | جزيئاتها ترابطها ضعيف جداً | جزيئاتها أقل مترابطة |
| المسافات الجزيئية | صغيرة جدا | كبيرة | متوسطة |
خواص المادة الطبيعية
اللون - الطعم - الرائحة
1- مواد موصلة للحرارة و الكهرباء النحاس الالمونيوم الحديد
2- مواد قابلة للطرق و السحب و التشكيل النحاس الالمونيوم الحديد
3- مواد عازلة للحرارة والكهرباء الكربون الكبريت
4- مواد غير قابلة للطرق و السحب و التشكيل الكربون ، الكبريت
خواص المادة الطبيعية
تختلف في الكثافة و قدرتها على الطفو على سطح الماء :
المواد الأقل كثافة من الماء تطفو على سطحه
المواد الأكثر كثافة تنغمر فيه
حركة الجزيئات
عند اكتساب المادة الصلبة للحراة
( تتحرك الجزيئات بسرعة )
حتى تتحول إلى الحالة السائلة
( حركة الجزيئات أسهل )
وعند الاستمرار في التعرض للحرارة تتحول إلى الحالة الغازية
( تصبح الجزيئات حرة )
كل مادة تتكون من جزيئات
كل جزيء يتكون من ذرات
كل ذرة تتكون من نواة ( في المنتصف ) و الكترونات
الذرة
أصغر وحدة بنائية في العنصر وتتكون من :
-النواة : جسيم صغير الحجم شحنتها موجبة موجودة في مركز الذرة
| الرمز | الشحنة | |
| بروتون | P | موجبة الشحنة |
| نيوترون | n | عديمة الشحنة |
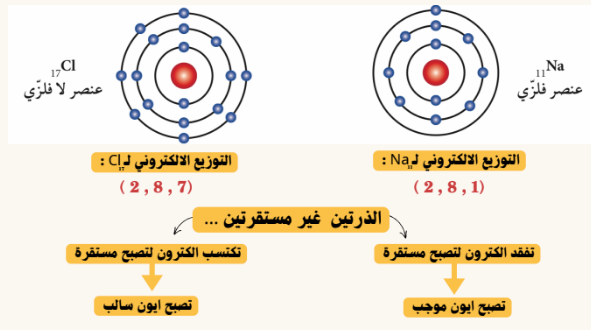
-الالكترونات جسيمات سالبة الشحنة تدور حول النواة في مستويات ( مستويات الطاقة ) وشحنتها سالبة
تتوزع الالكترونات حول أنوية العناصر بحيث :
المستوى الاول : يتشبع بـ ٢ الكترون و يستقر بـ ٢ الكترون
المستوى الثاني :يتشبع بـ ٨ الكترون و يستقر بـ ٨ الكترونات
المستوى الثالث : يتشبع بـ ١٨ الكترون و يستقر بـ ٨ الكترونات
تتركز كتلة الذرة في النواة ؟
لانها تضم البروتونات و النيوترونات وكتلتهما متقاربة و الالكترون اقل
الذرة متعادلة الشحنة ؟
لان عدد البروتونات الموجبة يساوي عدد الالكترونات السالبة
العدد الذري : هو عدد البروتونات التي توجد داخل ذرة العنصر
العدد الذري : هو مجموع عدد البروتونات و النيوترونات داخل ذرة العنصر
العدد الذري = عدد البروتونات = عدد الالكترونات
العدد الكتلي = عدد البروتونات + عدد النيوترونات
لكل ذرة عنصر عدد مختلف من البروتونات مختلف عن ذرات عن ذرات العناصر

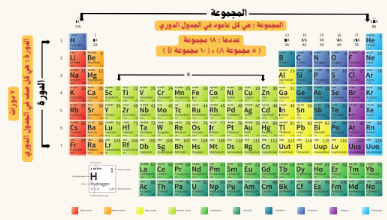
الجدول الدوري الحديث: هو جدول تظهر فيه خواص العناصر في نموذج متكرر ومنتظم
تقسين العناصر حسب نشاطها
| عناصر عديمة النشاط | عناصر قليلة النشاط | عناصر نشيطة جداً |
| لا تدخل في التفاعلات الكيميائية مثل العناصر النبيلة | تدخل في التفاعلات الكيميائية و تكون عدد محدود من المركبات | تدخل في التفاعلات الكيميائية و تكون مركبات عديدة |
العناصر النبيلة هي عناصر مستقرة بسبب امتلاء مستواها الخارجي بالالكترونات
الجدول الدوري الحديث:
العناصر النبيلة هي عناصر مستقرة بسبب امتلاء مستواها الخارجي بالالكترونات
المادة اما ان تكون عنصر او مركب
يوجد العنصر :
1- في حالة منفردة في الغازات النبيلة الهيليوم He, النيونNe , والارجونAr
2- في حالة صلبة في الفلزات كالالمنيومAl الحديد fe النحاسCu في صورة جزيئية كمعظم الجزيئات
3 -العناصر الغازية التي تتكون من ذرتين مثل O2 . N2 . CL2 . H2 في صورة جزيئية في العناصر اللافلزية
4-والتي تحوي جزيئاتها اكثر من ذرتين مثل الكبريت S , الكربون C , الفسفور P
اما المركب فيتكون الجزيء من نوعين أو اكثر من ذرات العناصر المكونة له
السؤال: العناصر النبيلة تقع في المجموعة (8A )وهي الاكثر استقرار ؟
الجواب : لان المستوى الخارجي لذراتها ممتلىء بالالكترونات
السؤال:تميل العناصر الى الارتباط بعناصر اخرى
الجواب :لتصل الى حالة الاستقرار

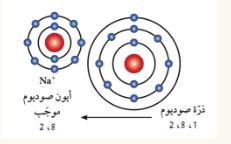 | 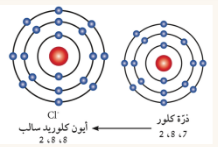 |
| حجمه الايون أقل من حجم الذرة لانها فقدت الكترون | حجمه الايون أكبر من حجم الذرة لانها اكتسبت الكترون |
الرابطة الكيميائية : هي قوة التماسك التي تربط الذرات أو الايونات مع بعضها البعض
الرابطة الايونية : هي قوة التجاذب الكهربائي الساكن بين الايونات المختلفة في نوع الشحنات
الايون : هي الذرة التي فقدت أو اكتسب الكترونا او اكثر من مستواها الخارجي للوصول الى حالة الاستقرار
