مراجعة محلولة كيمياء حادي عشر علمي فصل أول #أ. المقداد
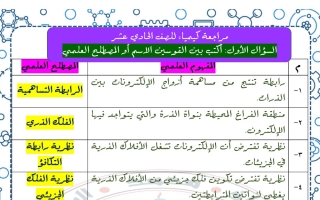
السؤال الأول : اكتب بين القوسين الاسم أو المصطلح العلمي
| المفهوم العلمي | المصطلح العلمي |
| رابطة تنتج من مساهمة أزواج الإلكترونات بين الذرات | الرابطة التساهمية |
| منطقة الفراغ المحيطة بنواة الذرة والتي يتواجد فيها الإلكترون. | الفلك الذري |
| نظرية تفترض أن الإلكترونات تشغل الأفلاك الذرية في الجزيئات | نظرية رابطة التكافؤ |
| نظرية تفترض تكوين فلك جزيئي من الأفلاك الذرية يغطي النواتين المترابطتين. | نظرية الفلك الجزيئي |
| فلك ترابطي من الأفلاك الذرية يغطي النواتين المترابطتين. | الفلك الجزيئي |
| تداخل فلكي ذرتين أما لرأس عندما يكون محور تداخل الفلكين محور التناظر | التداخل المحوري |
| رابطة تنتج عن تداخل فلكي ذرتين أسا لرأس عندما يكون محور تداخل الفلكين محور التناظر. | رابطة تساهمية سيجما |
| تداخل فلكي ذرتين جنبا إلى جنب عندما يكون محور الفلكين متوازيين ليتكون فلك جزيئي. | التداخل الجانبي |
| رابطة تنتج عن تداخل فلكي ذرتين جنبا إلى جنب عندما يكون محور الفلكين متوازيين | رابطة تساهمية باي |
| نظرية تنتج عن اندماج فلكين مختلفين عادة ( S،P) ليتكون فلك جديد يسمى فلكا مهجنا يمتاز بخواص وسطية بين الأفلاك التي خضعت للتهجين. | نظرية التهجين |
| فلك ينتج عن اندماج فلكين مختلفين عادة ( s،p) يمتان بخواص وسطية بين الأفلاك التي خضع للتهجين. | الفلك المهجن |
| عملية اندماج بين الأفلاك الذرية بوجود طاقة كافية تنتج أفلاك ذرية مهجنة ذات خواص وسطية بين الأفلاك المندمجة. | عملية التهجين |
| نوع من أنواع التهجين يتم فيه دمج: فلك واحد 2S. ثلاثة أفلاك 2P لتكوين أربعة أفلاك مهجنة | تهجين SP3 |
| نوع من أنواع التهجين يتم فيه دمج فلك واحد 2S مع فلكين 2P لتكوين ثلاثة أفلاك مهجنة. | تهجينSP2 |
| نوع من أنواع التهجين يتم فيه دمج فلك واحد 2S مع فلك لتكوين فلكان مهجنات يعتبر أصل المركبات الأروماتية وصبغته الجزيئية C6H6. | البترين |
| الرابطة التي تجمع جزيئات الماء القطبية | الرابطة الهيدروجينية |
| جزيئات الماء التي تتحد مع أبونات الذاب الحادا قويا جدا لدرجة أنها لا تنفصل عن الملح عند تبلره من المحلول | ماء التبلر |
| اتحاد قوي جدا لأيونات الملح مع جزيئات الماء | التبلر |
| الوسط الذيب في العلوك وهو الكون الرئيسي للمحلول | المذيب |
| الدقائق المذابة في المحلول وهو المكون الثانوي للمحلول | المذاب |
| عينات الماء التي تحتوي على مواد ذائبة | المحاليل المائية |
| مخاليط متجانسة وثابتة لا ينفصل المذاب فيها ولا يترسب في القاع إذا ترك المحلول بعد تحضيره الفترة. | المحاليل ( المحاليل الحقيقة ) |
| عملية تحدث عندما يذوب المذاب وتتم إماهة الكانيونات والأنيونات بالمذيب | عملية الإذابة |
| إحاطة جزيئات الذيب ( الماء) بكل من أنيونات وكاتيون المذاب | الإماهة |
| المركبات التي توصل التيار الكهربائي في المحلول المائي أو في الحالة المنصهرة | المركبات الإلكتروليتية |
| المركبات التي لا توصل التيار الكهربائي سواء في المحلول المائي أو في الحالة المنصهرة. | المركبات غير الإلكتروليتية |
| المحلول الذي يحتوي على اكبر كمية من المذاب في كمية معينة من المذيب على درجة حرارة ثابتة. | المحلول المشبع |
| المحلول الذي أضيف إليه مذاب ما ومرك وبقي بعد التحريك قسم من المذاب غير ذائب. | المحلول المشبع |
| المحلول الذي لا يزال يستطيع إذابة كميات إضافية من المذاب | المحلول غير المشبع |
| كتلة المادة التي تذوب في كمية معينة من المذيب عند درجة حرارة معينة لتكوين محلولا مشبعا. | الذوبانية |
| امتزاج يحدث للسوائل التي تذوب في بعضها بعضا مهم كانت كمية كل منهما. | امتزاج كلي |
| امتزاج السوائل شعيعة الذوبات كل منهما في الآخر. | امتزاج جزيئي |
| السوائل التي لا تذوب أمدها في الآخر. | عديمة الامتزاج |
| المحلول الذي يحتوي على كمية من الذات زائدة على الكمية المسموح بها نظريا تركيز المذاب أكبر مما يجب أن يكون عليه عند التشيع عند درجة حرارة معينة. | المحلول فوق المشبع |
| مقياس لكمية المذاب في كمية معينة من المذيب. | تركيز المحلول |
| المحلول الذي يحتوي على تركيز منخفض من المذاب | المحلول المخفف |
| المحلول الذي يحتوي على تركيز مرتفع من المذاب. | المحلول المركز |
| عدد مولات المذاب في ( 1L) من المحلول. | المولالية ( التركيز المولاي ) |
| عدد مولات المذاب في ( 1kg) من المذيب. | المولالية ( التركيز المولاي ) |
| التغيرات في الخواص الفيزيائية للسائل الذيب عند إضافة المذاب إليه. | الخواص المجمعة للمحاليل |
| الخواص التي تتأثر بعدد جسيمات المذاب بالنسبة إلى عدد جزئيات المذيب ولا تتأثر بنوعها. | الخواص المجمعة للمحاليل |
| ضغط البخار على السائل عند حدوث حالة اتزان بين السائل وبخارة عند درجة حرارة معينة | الضغط البخاري |
| التغير في درجة غليان محلول تركيزه المولالي واحد المذاب جزيئي وغير متطاير | ثابت الغليان المولالي |
| التغير في درجة تجمد محلول تركيزه المولالي واحد الذاب جزيئي وغير متطاير | ثابت المجمد المولالي |
| أهم فروع الكيمياء الفيزيائية التي تهتم بدراسة التغيرات الحرارية التي ترافق التفاعلات الكيميائية. | الكيمياء الحرارية |
| جزء معين من المحيط الفيزيائي الذي هو موضوع الدراسة | النظام |
| ما تبقى من القضاء الذي يحيط بالنظام الطاقة التي تتدفق داخل النظام أو خارجه بسبب وجود اختلاف في درجة الحرارة بين النظام ومحيطه | المحيط |
| التفاعلات التي تنتج طاقة مرارية بمنهها المحيط خارج النظام | الحرارة |
| التفاعلات التي يكون التغير في الانتالي لها أقل من صفر ( لها إشارة سالبة) | تفاعلات طاردة للحرارة |
| التفاعلات التي تحتاج إلى طاقة مرارية يمنهها النظام من محيطه | تفاعلات ماصة للحرارة |
| التفاعلات التي يكون التغير في الانشائي لها أكبر من صفر ( لها إشارة موجبة). | تفاعلات ماصة للحرارة |
| تفاعلات تتعادل فيها كمية الحرارة اللازمة لتفكيك الروابط في جزيئات التفاعلات مع كمية الحرارة اللازمة لتكوين الروابط في جزيئات النواتج | تفاعلات طاردة للحرارة |
| كمية الحرارة الممتهة أو المنطلقة خلال تفاعل كيميائي تحت ضغط ثابت | التغير في الانثالبي |
| كمية الحرارة التي تنطلق أو ثمنه عندما يتفاعل عدد من المولات للمواد المتفاعلة بعضها مع بعض خلال تفاعل كيميائي لتتكون مواد ناتجة. | حرارة التفاعل |
| محصلة تغيرات الطاقة الناتجة عن تحظم ( كسر الروابط الكيميائية في المواد المتفاعلة وتكوين روابط جديدة في المواد الناتجة. | حرارة التفاعل |
| التغير في المحتوى الحراري ( الانتالبي) المصاحب لتكوين موال واحد من المركب انطلاقا من عناصره الأولية ، وأن جميع المواد تكون في مالتها القياسية عند 25C | حرارة التكوين القياسية |
| كمية الحرارة المنطلقة عند احتراق مول واحد من المادة شهرية أو مركبة امتراثا تاما في وفرة من الأكسجين أو الهواء الجوي عند 25C وتحت ضغط يعادل atm 1 | حرارة الاحتراق القياسية |
| حرارة تفاعل كيميائي ما تساوي قيمة ثابتة سواء حدث هذا التفاعل مباشرة خلال خطوة واحدة أو خلال عدة خطوات | قانون هس |
| عند جمع المعادلات الكيميائية الحرارية لتفاعل ما التحصل على المعادلة النهائية يتم أيضا جمع الحرارة الناتجة عن كل تفاعل لتحصل على حرارة التفاعل النهائية | قانون هس للجمع الحراري |
السؤال الثاني: علل لكل مما يلي تعليلا علميا صحيحا
1- لا يمكن تحديد مكان الإلكترون وسرعته بدقة تامة في الوقت نفسه.
الجواب :لأن الحركية الموجبة للإلكترون ليس لها مكان محدد.
2-جزئ الهيدروجين يحتوي على رابطة واحدة من النوع سيجما.
الجواب :الاحتواء كل ذرة هيدروجين على فلك يحتوي الكترون منفرد في 1S حيث يتداخل الفلكان 1S في ذرتين الهيدروجين رأسا لرأس.
3- تحتوي بنية غاز الكلور CI- Cl على رابطة واحدة سيجما 17Cl:1s2 2s2 2p6 3s2 3p5
الجواب :لأنه يتداخل الملكات Pz من ذرتي الكلون أما الرأس لتكوين رابطة تساهمية على طول المحور Pz – Pz
4- الرابطة سيجما في جزئ الهيدرومين أقوى من الرابطة سيجما في جزى الكلور
الجواب : القصر المسافة بين نواني ذرني الهيدروجين وهذا يزيد من قوة الرابطة سيجما على عكس جزى الكلور.
5-يتكون جزئ النيتروجين من ثلاث روابط تساهمية واحدة سيجما واثنتين باي 3 2p 2 2s N:1s2
17
الجواب :لانه عندما المشاركة الدرنات الإلكترونات الثلاثة المنفردة بتداخل ذلك واحد فقط من كل ذرة نيتروجين مع ذلك من ذرة أخرى وأنا لرأس على طول المحور الذي يصل نوائي الذرتين لتكوين الرابطة التساهمية سيجماة ، ويتوارى فلكان من كل ذرة مع فلكين من الذرة الأخرى (2Px , 2Px – 2Pz , 2Pz)
6- الرابطة التساهمية سيجما قوية صعبة الكسر بينما الرابطة باي ضعيفة سهلة الكسر
الجواب :لأن الرابطة سيجما قصيرة وقوية وكثافتها الإلكترونية كبيرة بينما الرابطة باي طويلة وضعفيه وكثافتها الإلكترونية أقل.
7-جزئ كلوريد الهيدروجين يحتوي على رابطة واحدة من النوع سيجما. 1H : 1S1 17Cl:1s2 2s2 2p6 3s2 3p5
الجواب :لأنه يتداخل الفلك 1s من ذرة الهيدروجين مع الفلك 3pz من ذرة الكلون أسماء الرأس لتكوين رابطة سيجما على طول المحور PZ
8-الرابطة سيجما بين ذرتي الكربون في جزئ الإيتاين أقوى من الرابطة سيجما بين ذرتي الكربون في جزئ الإيثين.
الجواب :لأن عدد الروابط التي تكونها ذرتي الكربون في جزئ الإيثابن أكبر من عدد ال الروابط التي تكونها ذرتي الكربون في جزى اللإيشين الأن طاقة الرابطة سيجما تعتمد تساهمية اليس لها تكون الغازات النبيلة روابط تساهمية على عدد الروابط التي تشكلها الذرتين
9- طبقا لنظرية رابطة التكافؤ لا تكون ال القدرة على التفاعل وتكوين روابط).
الجواب :لأن جميع أفلاكها الذرية مشبعة ( ممثلثة بالإلكترونات) فلا تحتوي على الكترونات منفردة لتتداخل وتكون روابط
10-لا يمكن الاعتماد على نظرية رابطة التكافؤ لشرح تكوين الروابط في جزيء الميثان
الجواب :لأن ذرة الكربون وفق هذه النظرية لن تتمكن إلا من تكوين رابطتين فقط لوجود الكترونين اثنين منفردين فقط
11-تكافؤ الكربون في معظم الأحيان رباعي.
الجواب :لأنه عندما تكتسب ذرة الكربون طاقة ( إثارة) ينتقل إلكترون من الفلك 2S إلى الفلك 2pz ويصبح لديه أربع إلكترونات منفردة ويصبح الترتيب الإلكتروني في مستوى الطاقة الخارجي 3 2p C:2s1 ثم تحدث عملية التهجين حتى تصبح الروابط الأربعة للكربون متماثلة
12- التهجين في جزئ البنان من النوع SP3
الجواب : لأنه يتم فيه دمج فلك 2s مع ثلاثة أفلاك 2p لتكوين أربعة أفلاك مهجنة من النوع Sp3 التي تتداخل مع أفلاك 1S الأربعة لذرات الهيدروجين بروابط تساهمية سيجما
13-التهجين في جزئ الإيشين النوع 2P2
الجواب :لأنه يتم فيه دمج فلك واحد 2s مع فلكين 2P لتكوين ثلاثة أفلاك مهجنة من النوع Sp2 ويتبقى فلك واحد غير مهجن
14-التهجين في جزئ اللإيشين النوع SP.
الجواب :لأنه يتم فيه دمج فلك واحد 2S مع فلك 2P لتكوين فلكين ميجنين من النوع SP أو يتبقى فلكين غير مهجنين
15- جميع الروابط في جزئ الميثان تساهمية أمادية ( سيجما).
16-يحتوي المينات على أربعة روابط تساهمية أحادية.
الجواب:لتداخل أربعة أفلاك مهجنة (SP3) من ذرة الكربون مع أربعة أفلاك ذرية لذرات الهيدروجين رأسا الرأس.
17-تحتوي بنية جزى الإيشين على رابطة تساهمية ثنائية.
الجواب : وذلك لتداخل فلك همين ( SP2) من كل ذرة كربون رأسا لرأس مكونا رابطة سيجما و تداخل فلك غير مهجن من كل ذرة كربون منها جنبا لجنب مكونا رابطة أخرى باي.
18-تحتوي بنية جزى الإيناين على رابطة تساهمية ثلاثية.
الجواب :وذلك لتداخل تلك مهين ( SP) من كل ذرة كربون رأسا لرأس مكونا رابطة و تداخل فلكين غير مهجين من كل ذرة كربون جنبا لجنه مكونا رابطتين باي
19-الميثان CH4 أقل نشاطا من الليثين C2H4
20-يتفاعل البنات بالاستبدال بينما يتفاعل الإيثين بالإضافة.
الجواب :لأن جميع الروابط في الميثان سيجما قوية صعبة الكسر فيتفاعل بالاستبدال ولا يتفاعل بالإضافة لذلك يكون أقل نشاطا من الإيثين (يحتوي رابطة ثنائية) الذي يحتوي على رابطة باي سهلة الكسر فيتفاعل بالإضافة
21-الرابطة سيجما بين ذرتي الكربون في جزئ الإيثاين أقوى من الرابطة سيجما بين ذرتي الكربون في جزئ الإيثين.
الجواب :لقهر المسافة بين نواتي ذرتي الكربون في جزئ الإيناين مما يزيد من قوة الرابطة سيجما بينهما على عكس ذرتي الكربون في جزئ الإيشين حيث أن المسافة بينهما أطول.
22- حلقة البترينC6H6 متماسكة.
الجواب :لاحتواء حلقة البترين على روابط سيجما الأحادية القوية صعبة الكسر.
23- استقرار جزى البترين C6H6
24-عدم التمركز التام في نظام الرابطة باي في ملقة البترين يؤدي إلى استقرارالجزيء
الجواب : لحدوث تداخل جنبا إلى جنب للأفلاك الذرية Pz من الاتجاهين ( 1) و () مؤديا إلى عدم تمركز تام في نظام باي مما يؤدي إلى استقرار الجزئ.
25- الروابط التساهمية في الماء ( (O – H)) لها خاصية قطبية بدرجة كبيرة.
الجواب : لأن الأكسجين أكثر سالبية من الهيدروجين بالتالي يجذب زوج الإلكترونات المكون- للرابطة التساهمية (O – H) وتكتسب ذرة الأكسجين شحنة سالبة جزئيا في مين تكتسبت ذرات الهيدروجين الأقل سالبية كهربائية شحنة موجبة جزئيا
26- جزئ الماء لكل له خاصية قطبية
الجواب : لأن الأكسجين أكثر سالبية من الهيدروجين. فيجذب زوج إلكترونات الرابطة فتكتسب ذرة الأكسجين شحنة سالبة جزئيا وتكتسب ذرات الهيدروجين الأقل سالبية كهربائية شحنة موجبة جزئيا والأن قطبية الروابط ((O – H) ) في جزئ الماء متساوية لكنها لا تلغي بعضها الآخر بسبب شكلها الزاوي (104.5) لذلك جزئ الماء قطبي.-
27-قطبية الروابط في جزئ الماء متساوية ، لكنها لا تلفي بعضها الآخر.
الجواب :لأن الزاوية بين روابط الهيدروجين والأكسجين في جزء الماء ( 104.59) وبسبب هذا الشكل الزاوي فإن قطبية كل من الرابطين ((O – H) ) لا تلغي بعضها الآخر.
28- للماء قدرة على الإذابة الماء مذيب قوي).
الجواب : بسبب القيمة العالية لثابت العزل الخاصة به وتجمع جزئيات الماء القطبية التي تفصل الأيونات المختلفة الشحنة للمذاب بعضها عن بعض وتجذبها بعيدا الواحدة عن الأخرى.
29- ارتفاع درجة الغليان ومرارة التبخير والتوتر السطحي والسعة الحرارية وانخفاض الضغط البخاري للماء عن المركبات المتشابهة له أو ( درجة غليان الماء أكبر بكثير من درجات غليان المركبات المشابهة له في التركيب)
الجواب : بسبب تجمع جزئيات الماء القطبية وتكوين الروابط الهيدروجينية بين جزئيات الماء.
30- تكون ما يسمى ماء التبلير أو تكون بلورات مائية من كبريتات النحاس الثنائية.
الجواب :لأن جزئيات الماء تتحد مع أيونات المذاب اتحادا قويا جدا لدرجة أن الملح عندما يتبلر من المحلول المائي تنفصل البلورات وتتحد بالماء.
31- ينفذ الكيمائيون تفاعلات عدة في المحاليل السائلة.
الجواب :لأن الجزئيات والأيونات تكون أكثر قدرة على الحركة في الحالة السائلة ما يمكنها. التفاعل مع بعضها بسرعة أكبر.
32-لا يوجد الماء كيميائيا في صورة نقية تحتوي ماء الهنيون على كميات مختلفة من المعادن والغازات الذائبة.
الجواب : لأنه يذيب الكثير من المواد التي تتواجد معه الماء مذيب قوي
33- عند ترشيح محلول خلال ورقة ترشيح لن تحجز أيا من المذيب أو المذاب.
الجواب :لأن جسيمات المذاب أيونية أو جزيئية ( صغيرة جدا) حيث يكون متوسط أقطارها أقل من واحد نانومتر ( 1nm)
34- لا ينفصل كلوريد الصوديوم من محلوله ولا يرسب في القاع إذا ترك المحلول بعد تحضيره لفترة.
الجواب : لأن جسيمات المذاب أيونية أو جزيئية حيث يكون متوسط أقطارها أقل من واحد نانومتر ( m) -9 nm = 10 1)
35-ذوبان كلوريد الصوديوم بالماء.
الجواب :لأن جزيئات الماء في حركة مستمرة بسبب طاقتها الحركية. فتصطدم جزيئاته بالبلورة وتجذب أبونات المذاب ( NaCl) إليها وتبدأ عملية الإذابة بمجرد انفصال الكاتيونات والأنيونات.
36- تذوب معظم المركبات الأيونية في الماء.
الجواب :لتجاذب الأنيونات والكاتيونات للمذاب ( المركب الأيوني) للأطراف المشحونة الجزيئات الماء القطبية ( المذيب).
37-كبريتات الباريوم ( RaSO4) وكربونات الكالسيوم ( CaCO3) الله تذوب في الماء
الجواب :لأن التجاذب بين الأيونات في بلورات تلك المركبات أقوى من التجاذب الذي تحدته جزئيات الماء لهذه الأيونات بالتالي لا تحدث عملية إماهة لأبونات هذه المركبات بدرجة واضحة أي أنها لا تذوب في الماء.
38- يذوب الزيت في البترين أو يمكن إذابة البقع الزيتية من الملابس بالبترين).
الجواب :وذلك لأن كلا منهما غير قطبي فتنعدم قوى التنافر بينهما فتذوب في بعضها البعض
39- الماء والزيت للايختلطات الله يذوب الزيت في الماء
الجواب : لأن الزيت مركب غير قطبي فلا يستطيع أن يختلط بجزيئات الماء القطبية الرتباطهما مع بعضهما البعض بروابط هيدروجينية.
40- ذوبات النفتالين في البترين اكثر من ذوبان فلوريد السيزيوم في البترين.
الجواب :لأن كل من النفتالين والبترين مركبات غير قطبية ويذوب كل منهما في الآخر بسبب انعدام قوى التنافر بينهما أما فلوريد السيزيوم مركب أبوني فالبترين ليس له القدرة على جذب الأيونات أو إما هتها.
41- كبريتات الباريوم أو كربونات الكالسيوم توصل الكهرباء في الحالة المنصهرة ورديئة التوصيل في حالة المحلول المائي.
الجواب : لأنه مركب أيوني لا يذوب في الماء تقريبا لذلك ردي ، التوصيل في حالة المحلول المائي أما في الحالة المنصهرة معنوي على أيونات مرة الحركة تنقل التيار الكهربائي.
42- المركبات غير الإلكتروليتية للتوصل الكهرباء أو ( محلول الجلوكون ( الجليسرين) في الماء غير الكتروليتي).
الجواب : لأنها لا تتأين في الماء حيث أن محاليلها أو مصاهرها لا تحتوي على أيونات لنقل التيار الكهربائي
43- الحلول المائي لغان كلوريد الهيدروجين HCI يوصل الكهرباء ( مركب الكتروليتي).
الجواب : لأنه عند إذابة غاز كلوريد الهيدروجين في الماء يتكون أيون الهيدرونيوم (O+(H3 ) وأبون الكلوريد ( CI) ويصبح المحلول المائي لكلوريد الهيدروجين أو حمضت الهيدروكلوريك موصلا للكهرباء أي يصبح الكترولينيا.

44-المحلول المائي لغاز الأمونيا: NH3 يوصل الكهرباء ( مركب الكتروليتي).
الجواب :لأنه عند إذابة غان الأمونيا في الماء يتكون أنبون الهيدروكسيد (OH ) وكانيون ( (NH4) ويصبح المحلول المائي لغاز الأمونيا موصلا للكهرباء أي يصبح الكترولينيا

45-غاز الأمونيا: NH4 وغان كلوريد الهيدروجين HCI في الحالة النقية ( المسالة) لله يوصلات الكهرباء ( مركبات غير الكتروليتية).
الجواب :لعدم احتواء كلا منهما في الحالة النقية على أبونات مرة الحركة تنقل التيار الكهربائي
46- محلول كلوريد الصوديوم NaCl إلكتروليت قوي.
الجواب :لأنه عند ذوبانه في الماء يتفكك تفككا كاملا وتتواجد كمية كبيرة منه على شكل أيونات منفصلة تتحرك في المحلول وتوصل الكهرباء
47-محلول كلوريد الزئبق HgCl2(II) أو كلوريد الرصاص ll) إلكتروليت ضعيف.
الجواب :لأنه عند ذوبانه في الماء يننلك جزئيا ويتواجد جزء ضئيل منه على شكل أبونات وجزء كبير على شكل بلورات HgCl2 غير متأينة.
48-يضيء المصباح بشدة إذا غمرنا الإلكترودين في محلول كلوريد الصوديوم بينما يكون ضوء الصباح خافت إذا غمر هذين الإلكترودين في محلول كلوريد الزئبق ( ll)
الجواب : لأن كلوريد الصوديوم الكتروليت قوي عندما يذوب في الماء فانه يتفلك تفككا كاملا و تتواجد كمية كبيرة منه على شكل أبونات منفصلة مذابة وتتحرك في المحلول وتوصل التيار الكهربائي بينما محلول كلوريد الزئبق ( ll) إلكتروليت ضعيف عندما يذوب في الماء فإنه يتفلك جزئيا ويتواجد جزء ضئيل منه على شكل أيونات وجزء كبير على شكل بلورات HgCl غير متأينة
49- لا يضئ الصباح غذا غمرنا اللإلكترودين في محلول الجلوكون أو الكحول الإيتيلي ( الكحول الطبي).
الجواب : لأن ( الجلوكوز - الكحول الإيثيلي ) مركبات غير إلكتروليتية لا تحتوي على أيونات ( لا يتأين في الماء )
50- عند طحن الذاب إلى جسيمات صغيرة تسرع عملية الإذابة أو السكر المطحون أسرع ذوبات من سكر المكعبات.
الجواب : بسبب زيادة مساحة السطح المشتركة بين الذيب والمذاب وبذلك تسرع عملية الإذابة
51- عملية التسخين تساعد على سرعة الذوبان بارتفاع درجة الحرارة تزداد ذوبانية المادة بشكل ملحوظ.
الجواب : لأن طاقة حركة جزيئات الماء تزداد عند درجة الحرارة المرتفعة ، ما يزيد من احتمالات قوى تصادم جزيئات الماء بسطح البلورات ، فيساعد على سرعة ذوبانه
52-تكون فقاعات هوائية قبل وصول الماء إلى درجة غليانه
الجواب :لأنه بزيادة درجة الحرارة تقل ذوبانية الغاز ويكتسب طاقة حركية فتتصاعد غازات الهواء الجوي الذائبة من المحلول وتتحول إلى الحالة الغازية
53- حدوث التلوث الحراري للأنهار عند رمي المصانع المياه الساخنة فيه
الجواب : لأن ارتفاع درجة حرارة مياه النهر يؤدي إلى تقليل تركيز الأكسجين المذاب ( تقل ذوبانيته) مما يؤثر سلبا على الحياة النباتية والحيوانية المائية.
54-عند وضع بعض الأسماك في موض به ما سبق غليه وتم تبريده بسرعة فإن جميع الأسماك تموت بعد فترة قليلة.
الجواب : لأنه كلما ارتفعت درجة الحرارة قل ذوبان الغاز في الماء وبالتالي يتحول الغاز من الصورة المذابة إلى غاز يتصاعد فتقل نسبة الأكسجين المذابة مما يؤدي إلى موت الأسماك
55- تعبأ زجاجات المشروبات الغازية تحت ضغط عال من غاز ثاني أكسيد الكربون.
الجواب : بسبب زيادة ذوبانية الغاز كلما ازداد الضغط الجزيئي له على سطح المحلول
56- يتغير طعم المشروب الغاني إذا تركت زجاجته مفتوحة لفترة.
الجواب : لأنه عند فتح زجاجة المشروب الغاني بقل الضغط الجزئي لغان CO2 على سطح المشروب مباشرة ، فيقل تركيز غاز CO2 الذائب وتتسرب فقاعاته من فوهة الزجاجة فيتغير طعم المشروب لفقدانه غاز CO2
57-الضغط البخاري للمسائل يزداد بارتفاع درجة الحرارة.
الجواب : لانه كلما زادت درجة الحرارة زادت كمية البخر الناتج من السائل وبالتالي يزداد الضغط البخاري للسائل
58- الضغط البخاري للمحلول أقل من الضغط البخاري للمذيب النقي عند نفس درجة الحرارة
59-الضغط البخاري لمحلول السكر في الماء أقل من الضغط البخاري للماء النقي.
الجواب :يرجع ذلك لأن بعض جسيمات المذاب تحل محل بعض جزيئات المذيب الموجودة على سطح المحلول وبالتالي يقل عدد جزيئات المذيب التي يمكن الانطلاق إلى الحالة الغازية.
60-تضطر سلطات بعض الدول التي تنخفض فيها درجات الحرارة إلى ما دون الصفر لرش الطرقات بالملح الصلب
الجواب : لأن الملح الصلب يعمل على خفض درجة تجمد الماء فيمنع تكون الجليد على الطرق مما يجد من حوادث الانزلاق
61-يستخدم سائقي السيارات مادة مضادة للتجمد ( مثل جليكول إيثيلين) في مبردات السيارات في المناطق الباردة.
الجواب : وذلك لتجنب تجمد الماء لأن هذه المادة ( مادة غير متطايرة وغير الكتروليتية ) تعمل أعلى خفض درجة تجمد الماء.
62-يضيف سائقي السيارات مادة الجليكول إيتيلين إلى مبردات السيارات في المناطق الحارة
الجواب : لأنها مادة غير متطايرة وغير الكتروليتية تعمل على رفع درجة غليان الماء
63- يستخدم التركيز المولالي عند حساب الارتفاع في درجة الغليات والانخفاض درجة التجمد ولا يستخدم التركيز المولاري.
الجواب :لأن الخواص المجمعة للمحاليل تتأثر بعدد جسيمات الذاب بالنسبة إلى عدد جزيئات المذيب
64- التغير في الإنثالبي ΔH للتفاعل الطارد للحرارة يكون بإشارة سالبة أقل من الصفر
الجواب : لأن مجموع المحتويات الحرارية للمواد الناتجة أقل من مجموع المحتويات الحرارية للمواد الداخلة في التفاعل حيث يطرد النظام الحرارة إلى محيطه ( طاقة منطلقة)
65- التغير في اللإنثالبي ΔH للتفاعل الخاص للحرارة يكون بإشارة موجبة أكبر من الصفر
الجواب : لأن مجموع المحتويات الحرارية للمواد الناتجة أكبر من مجموع المحتويات الحرارية للمواد الداخلة في التفاعل حيث يمتص النظام الحرارة من محيطه ( طاقة ممتصة).
65- التغير في الإنثالبي ΔH للتفاعل اللامراري يساوي صفر.
الجواب : لأنها تفاعلات تتعادل فيها كمية الحرارة اللازمة لتفكيك الروابط في جزيئات المتفاعلات مع تلك الملازمة لتكوين الروابط أي أن النظام لا يطرد ولا يمتهن الحرارة من محيطه.
66- يعتبر تفاعل حمض الأسيتيك مع الإيثانول للإنتاج الاستر والماء من التفاعلات اللاحرارية
الجواب : لأنه تفاعل تتعادل فيها كمية الحرارة اللازمة لتفكيك الروابط في جزيئات المتفاعلات مع تلك اللازمة لتكوين الروابط فتكون ΔH=0 للتفاعل.
67- التغير الحراري الصاحب للتفاعل التالي لله يعتبر مرارة تكوين قياسية لغاز CO2
CO(g) + 1⁄2 O2(g) → CO2(g) , ΔH = -283.5 kj/mol
الجواب : لأن CO2 لم يتكون نتيجة اتحاد عناصره الأولية حيث أن CO مركب وليس عنصر
68-التغير الحراري الصاحب للتفاعل التالي للى يعتبر مرارة تكوين قياسية للماء.
2H2(g) + O2(g) → 2H2O(l) , ΔH = -572 kJ.
الجواب :لتكوين 2 مول من الماء وحسب حرارة التكوين القياسية لكل موك واحد من المادة المتكونة
69- التغير الحراري المصاحب للتفاعل الثاني الله يعتبر مرارة احتراق قياسية الكربون.
C(s) + 1⁄2 O2(g) → CO(g) , ΔH = -110 kJ / mol
الجواب :لأن الكربون لم يحترق احتراقا تاما في كمية وافرة من الأكسجين لأن الاحتراق التام ينتج عنه CO2
70- التغير الحراري المصاحب للتفاعل التالي لا يعتبر مرارة احتراق قياسية للألومنيوم
4Al(s) + 3O2(g) → N2O(g) , ΔH = -3340 kJ
الجواب :لأن المادة المحترقة4 مول من الألومنيوم وتحسب حرارة الاحتراق القياسية لكل مول واحد من المادة المحترقة
71- يعتبر التغير الحراري الصاحب للتفاعل التالي حرارة احتراق قياسية للنيتروجين
N2(g) + O2(g) → N2O4(g) , ΔH = +9.6 kJ / mol
الجواب :لأن التفاعل ماص للحرارة وحرارة الاحتراق القياسية حرارة منطلقة دائما وΔH تأخذ إشارة سالبة دائما.
72- التغير الحراري الصاحب للتفاعل التالي لا يعتبر حرارة التكوين قياسية لغاز C02 بينما يعتبر حرارة احتراق قياسية له.
CO(g) + 1⁄2 O2(g) → CO2(g) , ΔH = -283.5 kj/mol
الجواب :لا يعتبر مرارة تكوين قياسية لأن غاز 2 CO لم يتكون من عناصره الأولية حيث CO مركب وليس عنصر
ويعتبر حرارة احتراق قياسية الغاز أول أكسيد الكربون لأنه تم حرق مول واحد من CO احتراق تام في وفرة من الأكسجين وصاحبة انطلاق طاقة حرارية. ٧
73-حرارة الاحتراق القياسية للهيدروجين تساوي حرارة التكوين القياسية للماء.
الجواب :لأنه عند احتراق مول واحد من غاز الهيدروجين في وجود الأكسجين تنطلق طاقة حرارية تساوي الطاقة الحرارية الناتجة عند تكوين مول واحد من الماء.
H2 + 1⁄2 O2(g) → H2O(l)
74-حرارة التكوين القاسية للأكسيد الألمونيوم ضعف حرارة الاحتراق القياسية للألمونيوم طبقا للمعادلة التالية:
2Al(s) + 1.5 O2(g) → Al2O3(s) ,Δ H = -1670 kJ/mol
الجواب : لانه عند تكوين مول واحد من أكسيد الألونيوم من عناصره الأولية في حالتها القياسية يحترق مولين من الألمنيوم احتراقا ناما مع انطلاق نفس كمية الحرارة في الحالتين
75-الحرارة المصاحبة للتغير التالي SO2(g) + 1⁄2 O2(g) + 49Kj → SO3(g) لا تعتبر مرارة احتراق قياسية لغاز ثاني أكسيد الكبريت.
الجواب :لأن الحرارة في التفاعل السابق متهة ( تفاعل ماص للحرارة) بينما حرارة الاحتراق القياسية حرارة منطلقة لكل مول من المادة المحترقة.