مراجعة وحدة المادة علوم فصل أول #الدلة 2023 2024
السؤال: أكمل ما يأتي:
1- تتميز المواد بخواص متعددة مثل اللون و الرائحة والطعم
2-حالات المادة هي الصلبة والسائلة والغازية وهي ثابتة بالنسبة للمادة الواحدة
3- قطرة الماء تحتوي على ما يقارب 10*23 جزيء
4-تتكون المادة من وحدات صغيرة جدا لا يمكن رؤيتها بالعين المجردة تسمى الجزيئات
5- مواد موصلة للكهرباء والحرارة وقابلة للطرق والسحب والتشكيل هي الحديد والنحاس والألمنيوم
6-مواد عازلة لا توصل الكهرباء والحرارة وغير قابلة للطرق والسحب والتشكيل هي الكربون والكبريت
7-مركبات تتكون من جزيئات ، وجزيئات المركب الواحد متشابهة في خواصها الطبيعية ويمكن أن تتواجد منفردة في الطبيعة مثل الماء و الكحول
8- لكل عنصر عددا من البروتونات مختلف عن ذرات العناصر الأخرى ويسمى هذا العدد من البروتونات العدد الذري للعنصر
9-عدد البروتونات في الذرة يسمى العدد الذري
10-مجموع عدد البروتونات والنيوترونات بالنواة يسمى العدد الكتلي
11- يمتلك الالكترون شحنة سالبة ، أما البروتون شحنته موجبة
12-مكونات الذرة هي البروتونات والنيوترونات و الالكترونات
13- كتلة البروتون تساوي 1840ضعفا من كتلة الالكترون
14- كتلة ذرة الليثيوم تساوي 7 أضعاف كتلة ذرة الهيدروجين
15-تتنوع الالكترونات حول أنوية العناصر بحيث يتسع المدار الأول لـ الكترونين والمدار الثاني لـ ٨ الكترونات وما زاد عن ذلك يدخل في المدار الثالث
16-عنصر الحديد رمزه Fe العددي الذري 26 الكتلة الذرية 55.847
17- يخرج من الدورة السادسة صف من العناصر يسمى اللانثانيدات
18- يخرج من الدورة السابعة صف من العناصر يسمى الأكتينيدات
19- جزيء الأكسجين يرمز له O2
20- مركب الماء H2O، وملح الطعام NaCl
21-رمز الجسيم السالب الشحنة في الذرة.e
22- رمز الجسيم عديم الشحنة في الذرة. n
23-رمز الجسيم موجب الشحنة في الذرة p
24- عدد مستويات الطاقة العنصر الليثيوم 3Li يكون 2
25-التوزيع الالكتروني لعنصر الأرجون 18Arهو 2.8.8
26- تحتوي معظم أنوية الذرات على بروتونات و نيوترونات
27-إذا كانت الذرة ( X) تحتوي على ( 15) بروتون فإن عدد الالكترونات في الذرة يساوي ( 15)
28-تنشأ الرابطة الأيونية بين فلز ولا فلز
29- عدد المجموعات في الجدول الدوري الحديث ( 8) مجموعات
30-عند اكتساب ذرة العنصر الكترونين فإنها تصبح مشحونة بـ شحنتين سالبتين
31-عندما تفقد ذرة العنصر الكترون فإنها تصبح مشحونة بـ شحنة موجبة
32- العنصر الذي يقع في الدورة الثانية يحتوي على عدد ذري يساوي 8
33- عملية تصوير يتم بواسطتها تحديد مكان الورم السرطاني بشكل دقيق تسمى الرنين المغناطيسي
34- كلما اتجهنا يمين الجدول الدوري فإن العدد الذري يزيد
35- يحتوي عنصر الفلور على ( 9) ذرات هذا يعني أن الدار الأخير للإلكترونات فيه ( 7) ذرات
36- تغير ينتج عنه مادة جديدة تختلف عن المادة الأصلية هو احتراق الوقود
37- عنصر فلزي يوجد في حالة صلبة AI
38- عنصر لا فلزي يوجد في صورة جزيئية S
39- عنصر كيميائي يتواجد في الماء العذب بشكل طبيعي هو الكالسيوم
40-عنصر كيميائي يلوث الماء العذب إذا خالطه هو الرصاص
41-من خلال دراستك للجدول الدوري فإن العدد الذري للعنصر يمثله الحرف A
السؤال: عرف ما يأتي:
1- العدد الذري: هو عدد البروتونات التي توجد داخل نواة العنصر.
2- العدد الكتلي: هو مجموع عدد البروتونات والنيوترونات داخل نواة ذرة العنصر.
3-الأيون: هو الذرة التي فقدت أو اكتسبت الكترونا أو أكثر من مستواها الخارجي للوصول إلى حالة الاستقرار.
4- الرابطة الكيميائية: هي قوة التماسك التي تربط الذرات أو الأيونات مع بعضها البعض.
5- الرابطة الأيونية: هي قوة التجاذب الكهربائي الساكن بين الأيونات المختلفة في نوع الشحنات.
6-الالكترونات هي جسميات سالبة الشحنة تدور حول النواة في مستويات.
7- البروتونات: هي جسيمات موجية الشحنة تشكل جزءا من نواة الذرة.
8- النيوترونات: هي جسيمات عديمة الشحنة تشكل جزءا من نواة الذرة.
9- الجزيء: هو أصغر وحدة من المادة ، يمكن أن يتواجد في حالة انفراد ويحتفظ بخواص المادة.
السؤال: اكتب عبارة ( صحيحة) أو ( خاطئة) أمام العبارات الآتية:
يتكون كل شيء من حولنا من مادة. الخواص الطبيعية ثابتة للمادة الواحدة. جزيئات المركب الواحد متشابهة في خواصها الطبيعية. تتحرك جزيئات المادة الصلبة وهي في مكانها. تتحرك الإلكترونات بسرعة عالية جدا في مستويات محددة حول نواة الذرة. كتلة البروتون تساوي كتلة الإلكترون وأصغر من كتلة النيوترون. تختلف المواد في كثافتها وقدرتها على الطفو على سطح الماء. المواد الأقل كثافة من الماء تطفو على سطحه. المواد الأكثر كثافة من الماء تتغمر فيه. جزيئات المادة الصلبة اذا اكتسبت طاقة حركة الجزيئات تزداد إلى أن تتحول إلى سائل وتصبح حركة الجزيئات أسهل وتنتقل من مكان إلى آخر في حدود السائل. جزيئات المادة الصلبة عند الاستمرار في تزويدها بالطاقة تتحول من الحالة السائلة إلى الغازية وتصبح الجزيئات حرة الحركة وتملأ المكان الذي توجد فيه. المواد تكون عناصر ومركبات أو خليط من عدة مواد. الالكترونات جسيمات صغيرة موجبة الشحنة. المواد تفقد الالكترونات أو تكسيها عند دلكها. عدد البروتونات يساوي عدد الالكترونات في الذرات. كتلة الذرة أصغر من مجموع كتل البروتونات والالكترونات الموجودة فيها. عدد الالكترونات السالبة في الذرة المتعادلة يساوي عدد البروتونات الموجبة. كلما اكتسبت جزيئات المادة طاقة تصبح حركتها أقل. الصفوف الأفقية في الجدول الدوري تسمى المجموعات. العناصر النبيلة هي التي تقع في المجموعة ( 8A). عناصر المجموعة الثامنة غازات خاملة لا تكون روابط كيميائية بسهولة. عنصر الهيليوم لا يميل إلى الارتباط بعناصر أخرى. معظم العناصر اللافلزية لديها القابلية لاكتساب الالكترونات. الأعمدة الرأسية في الجدول الدوري تسمى المجموعات. كتلة الذرة تتركز في النواة. اذا تشابهت العناصر في عدد الالكترونات المستوى الخارجي فإنها تتشابه في خواصها الكيميائية إما أن تكون المادة عنصرا ، إما مركبا. في المركبات يتكون الجزيء من نوعين أو أكثر من ذرات العناصر المكونة له. تتركز كتلة الذرة في الالكترونات. إذا اكتسبت الذرة الكترون تسمى أيون موجب.. النيون يصنف من الغازات النبيلة. تتشابه عناصر المجموعة الواحدة من حيث عدد الكترونات المستوى الخارجي أكثر العناصر استقرارا هي عناصر المجموعة 7A يمكن رؤية جزيئات المادة بالعين المجردة. العدد الذري للعنصر أقل من العدد الكتلي لنفس العنصر. يدل عدد مستويات الطاقة للعنصر على رقم مجموعته في الجدول الدوري.
| صحيحة) (خاطئة) (صحيحة) (صحيحة) (صحيحة) (خاطئة) (صحيحة) (صحيحة) ( صحيحة) ( صحيحة) (صحيحة) ( صحيحة) ( خاطئة) (صحيحة) (صحيحة) (خاطئة) (صحيحة) (خاطئة) ( خاطئة) (صحيحة) ( صحيحة) (صحيحة) (صحيحة) (صحيحة) (صحيحة)
(صحيحة) ( خاطئة) (خاطئة) ( صحيحة) ( صحيحة) ( خاطئة) ( خاطئة) (صحيحة) ( خاطئة) |
السؤال: علل لما يأتي:
1- لا نستطيع رؤية الذرة ؟
الجواب :لأنها متناهية الصغر ، وتتكون من جسيمات أصغر منها بكثير.
2-كتلة الذرة أكبر من مجموع كتل البروتونات والالكترونات الموجودة فيها ؟
الجواب : لوجود جسيمات عديمة الشحنة سميت النيوترونات.
3- تتركز كتلة الذرة في النواة ؟
الجواب : لأنها تضم البروتونات النيوترونات وكلتاهما متقاريتان
4- المادة في الحالة الصلبة شكلها ثابت ؟
الجواب :لأن جزئياتها مترابطة وتتحرك حركة اهتزازية في مكانها.
5- توضع عناصر اللانثانيدات والأكتينيدات بصورة منفصلة في الجدول الدوري ؟
الجواب :للحفاظ عليه من الاتساع الزائد.
6- العناصر النبيلة تقع في المجموعة ( 8A) وهي أكثر استقرارا ؟
الجواب : لأن المستوى الخارجي لذراتها ممتلئ بالإلكترونات.
7-تختلف صفات المواد من حولنا ؟
الجواب : بسبب اختلاف ترتيب جزئياتها.
8-تختفي الطرات المطر بعد وضعها دقائق في زجاجة ساعة ؟
الجواب :لأن جزئيات العطر سريعة التطاير وبالتالي تتبخر بسرعة وتنتشر في الهواء.
9-الذرة متعادلة كهربائيا ؟
الجواب :لأن عدد البروتونات الموجبة تساوي عدد الالكترونات السالبة
10-تميل الذرات للارتباط بعضها ببعض ؟
الجواب : لتصل إلى الاستقرار.
11-نواة الذرة موجبة الشحنة ؟
الجواب :لأنها تحتوي على البروتونات موجبة الشحنة والنيوترونات عديمة الشحنة.
12- يعتبر الماء H2O مركب ؟
الجواب : لانه يتكون من ذرات عناصر مختلفة
13- تطفو بعض المواد على سطح الماء ؟
الجواب :المواد الأقل كثافة من كثافة الماء تطفو على سطحه.
14-يغوص الحديد في الماء ؟
الجواب :كثافتها أكبر من كثافة الماء.
15-يستخدم عنصر النحاس في صناعة أسلاك الكهرباء ؟
الجواب : لأنه من العناصر الموصلة للكهرباء
16- عند وضع سائل في وعاء فان السائل يأخذ شكل الوعاء ؟
الجواب :لأن جزيئات السائل متوسطة الترابط وتتحرك حركة انزلاقية فوق بعضها البعض
17- يقع الليثيوم 3Li في الدورة الثانية المجموعة الأولى ؟
الجواب :لأن عدد مستويات الطاقة اثنان إذن الدورة الثانية والمستوى الخارجي يحتوى على إلكترون واحد.
18-تتشابه خواص عنصر الصوديوم 11 Na مع عنصر البوتاسيوم ( 19 K)
الجواب : لأن كلا منهم في المجموعة الأولى لاحتواء المستوى الخارجي على إلكترون واحد.
19- غاز النيون ( Ne10) لا يدخل في روابط كيميائية مع عناصر أخرى ؟
الجواب : لأن مستوى الطاقة الأخير مشبع بالإلكترونات أي أنه مستقر.
20- عناصر المجموعة الواحدة تتشابه في الخواص الكيميائية ؟
الجواب : لأن المستوى الاخير تتساوي به عدد الإلكترونات الخارجية.
21-ذرات الغازات النبيلة لا تكون روابط بسهولة ؟
الجواب :لأن المستوى الأخير مكتمل ومستقر.
22- غاز الهيليوم لا يرتبط مع عناصر أخرى ؟
الجواب : لأنه غاز نبيل/ لأن المستوى الخارجي لذراته ممتلئ بالإلكترونات/ لأنه مشبع/ لأنه مستقر.
السؤال:أجب عن الأسئلة الآتية:
1-توزع الالكترونات في الذرة في ( ۷) مستويات رئيسية حول النواة. عددها ؟
الجواب :
المستوى الأول الأقرب إلى النواة: يتشبع بـ ۲ الكترون ويستقر بـ ٢ الكترون.
المستوى الثاني: يتشبع بـ ٨ الكترونات ويستقر بـ ٨ الكترونات.
المستوى الثالث: يتشبع بـ ١٨ الكترونا ويستقر بـ ٨ الكترونات.
2- اين يوجد العنصر ؟
الجواب :
1- في حالة منفردة: في الغازات النبيلة كالهيليوم he ، النيون Ne ، الأرجون Ar
2- في حالة صلبة: في الفلزات كالألومنيوم Al ، والنحاس Cu ، والحديد Fe
3- في صورة جزيئية: كمعظم جزيئات العناصر الغازية التي تتكون من ذرتين مرتبطتين مثلH2-CL2-N2-O2
4- في صورة جزيئية: كبعض العناصر اللافلزية ، التي تحوي جزيئاتها أكثر من ذرتين مثل الكبريت S
الكربون C ، الفسفور P
السؤال:ماذا يحدث في الحالات الآتية ؟
1- عند إضافة كلوريد الصوديوم إلى نترات الفضة ؟
الجواب : يتكون راسب أبيض.
2- عند إضافة قطعة من الخارصين إلى حمض الهيدروليك ؟
الجواب : يتصاعد غاز الهيدروجين.
3-عند رش العطرية زاوية المختبر ؟
الجواب : تنتشر رائحة العطر لأن جزيئات المادة في حركة مستمرة العطر وتنتشر بين جزيئات الهواء.
4- عند وضع كيس شاي في كأس يحتوي ماء ساخن ؟
الجواب : ينتشر الشاي في الماء ويتغير لون وطعم ورائحة الماء لأن جزيئات الشاي تنتشر فالمسافات البينية لجزيئات الماء.
5- عند وضع قطرة من الحبر في كأس به ماء ؟
الجواب :تلون الماء بلون الحبر لأن الجزيئات في حالة حركة مستمرة انتشار الحبر).
6-عند وضع قطعة من الفلين على سطح الماء ؟
الجواب : يطفو الفلين على سطح الماء.
7-عند اتحاد ذرات من عناصر مختلفة مع بعضها البعض ؟
الجواب : يتكون مركب.
8-عند زيادة عدد البروتونات في الذرة عن عدد الإلكترونات ؟
الجواب :تصبح الذرة غير متعادلة كهربائيا.
9- عندما تكتسب ذرة العنصر اللافلز الكترون أو أكثر ؟
الجواب :تصبح ايون سالب ويصبح حجمها أكبر."
السؤال: أي مما يأتي لا ينتمي للمجموعة ضع خطا تحته مع ذكر السبب ؟
1-مسامير - سلك نحاس - كبريت - قصدير)
السبب: لأنه مادة رديئة التوصيل للحرارة والكهرباء ، أما الباقي مواد موصلة للحرارة والكهرباء
2- (حديد - نحاس - ذهب - خشب)
السبب: لأنه من المواد غير الموصلة للكهرباء ، أما الباقي مواد موصلة.
3- ( بخار الماء - حديد - زجاج - خشب )
السبب: لأنه حالة غازية ، أما الباقي حالة صلبة.
4- 18Ar - 10Ne - 7N - 2He
السبب: لأنه من العناصر غير المستقرة كيميائيا ، أما الباقي من العناصر النبيلة.
5-( الحديد - النحاس - الكبريت - الالومنيوم )
السبب: لأنه من اللافلزات ، أما الباقي من الفلزات.
6-( الربوتونات - الأكتينيدات - النيرتونات - الالكترونات)
السبب : لأنها ليست من مكونات الذرة .
7-( ماء - ألمنيوم - كحول - كلوريد الصوديوم )
السبب : لأنه عنصر ، أما الباقي مركبات .
السؤال: قارن بين كل من
| المقارنة | الحالة الصلبة | الحالة السائلة | الحالة الغازية |
| المفهوم | مترابطة وتتحرك حركة اهتزازية في مكانها | مترابطة وتتحرك حركة انتقالية تنزلق فوق بعضها بعضا | ذات ترابط ضعيف تتحرك حركة انتقالية عشوائية وسريعةفي جميع الاتجاهات |
| شكلها | ثابت | متغير | متغير |
| حجمها | ثابت | ثابت | متغير |
| حركة جزيئاتها | اهتزازية بسيطة | انزلاقية / انتقالية | عشوائية |
| قوة الترابط | قوية | مترابطة | ضعيفة الترابط |
| الصورة |  |  |  |
اقسام الذرة
| النواة | الالكترونات |
جسيم صغير الحجم تحتوي على الربوتونات موجبة الشحنة والنيوترونات عدمية الشحنة | تحرك بسرعة عالية جدا في مستويات محددة حول شحنتها سالبة |
دورات مجموعات الجدول الدوري
| المقارنة | الدورات | المجموعات |
| المسمى الاخر | صفوف | أعمدة |
| عددها في الجدول الدوري | 7 | 18 |
| مع زيادة العدد الذري الخاصية الفلزية ( تقل / تزداد ) | تقل | تزداد |
| مع زيادة العدد الذري الخاصية اللافلزية ( تقل / تزداد ) | تزداد | تقل |
| تشابه العناصر كيميائيا فيها | عدد مستويات الطاقة | عدد الكترونات المستوى الخارجي |
| المقارنة | العناصر اللافلزية | العناصر الفلزية |
| فقد او اكتساب الالكترونات | اكتساب الكترونات | فقد الكترونات |
| الايون السالب | الايون الموجب |
| معظم العناصر اللافلزية لديها القابلية لاكتساب الالكترونات لتصبح مشحونة بــ شحنة سالبة ، وإذا اكتسبت الكترونين تصبح مشحونة بشحنتني سالبتين ويكون حجم الأيون السالب أكبر من حجم الذرة المتعادلة ( باستثناء العناصر النبيلة ) | تميل العناصر الفلزية لفقد الكرتون أو أكثر ، لتصبح مشحونة بــ شحنة موجبة ، وإذا فقدت الكترونين تصبح مشحونة بشحنتني موجبتين ، ويكون حجم الأيون الموجب أصغر من حجم الذرة المتعادلة |
| المقارنة | البروتونات | الالكترونات | النيترونات |
| الرمز | p | e | n |
| الكتلة | كبيرة نسبيا | صغيرة جدا | كبيرة نسبيا |
| الشحنة الكهربائية | موجبة | سالبة | متعادلة / عديمة |
| مكان توجد في الذرة | النواة | تدور حول النواة | النواة |
| المقارنة | 17Cl | 3Li |
| التوزيع الالكتروني | 2.8.7 | 2.1 |
| المجموعة | 7 | 1 |
| الدورة | 3 | 2 |
| نوع ذرات العنصر | لافلز | فلز |
| المقارنة | Na11 | Cl17 |
| شحنة أيون الذرة | موجب | سالب |
| المقارنة | 9F | 3Li |
| عدد الكترونات المستوى الخارجي | 7 | 1 |
| المقارنة | 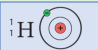 | 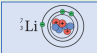 |
| عدد البروتونات | 1 | 3 |
| عدد الالترونات | 1 | 3 |
| عدد النيترونات | صفر | 4 |
| العددي الذري | 1 | 3 |
| العدد الكتلي | 1 | 7 |
السؤال: من خلال الرسوم البيانية التالية ، أجب :
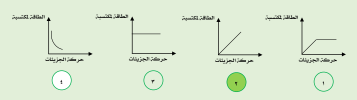
-الرسم البياني الذي يوضح العلاقة بين سرعة حركة الجزيئات والطاقة المكتسبة يمثله الرقم ( 2 )
السؤال: من خلال الاشكال التالية أجب
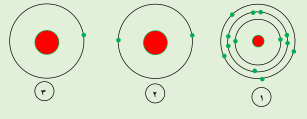
الشكل الذي يمثل عنصر من الغازات النبيلة يمثله الرقم (2)
الشكل الذي يقع في المجموعة 3A يمثله الرقم (1)
السؤال: من خلال الاشكال التالية أجب
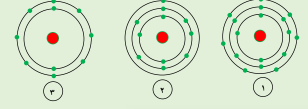
التوزريع الالكتروني الصحيح لذرة 17CL يمثله الرقم (1)
التوزيع الكتروني الصحيح لذرة 10Ne يمثله الرقم (3)
السؤال: من خلال الاشكال التالية أجب
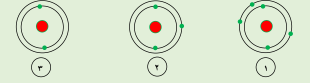
-العنصر الذي يقع في المجموعة الاولى يمثله الرقم ( 2 )
-العنصر الذي يقع في المجموعة الثانية يمثله الرقم ( 1 )
* الشكل المقابل يمثل ( التوزيع الألكتروني لعنصر الصوديوم )
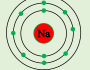
-يقع عنصر الصوديوم في الدورة رقم ( 3 )
-يقع عنصر الصوديوم في المجموعة رقم ( 1 )
* الشكل المقابل يمثل ذرة عنصر 17Cl حدد على الذرة التوزيع االالكتروني :

- عدد الربوتونات = ( 17 )
- عدد الالكترونات =( 17 )
-العدد الذري = ( 17 )
* من خلال الشكل المقابل أجب :
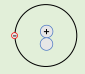
-العدد الكتلي في الذرة المقابلة يساوي ( 2 )
* من خلال الشكل المقابل أجب :
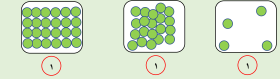
- جزيئات الهواء يمثلها الشكل رقم ( 1 )
- جزئيات العصير يمثلها الشكل رقم ( 2 )
* ادرس الأشكال التالية ثم أجب عما يأتي :
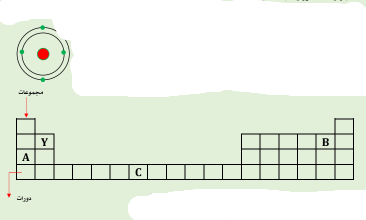
- يُمثل الشكل التالي التوزيع الاكتروني لعنصر افتراضي رمزه (Y )
1- حدد في الجدول التالي موقع العنصر ( Y)
* ادرس الأشكال التالية ثم أجب عما يأتي :
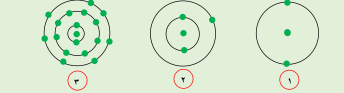
-الذرة التي لديها القابلية لاكتساب الالكترتونات يمثلها الشكل رقم ( 3 )
- الذرة التي لديها القابلية لفقد الالكترونات يمثلها الشكل رقم ( 2 )
* من خلال التجربة التالية أجب :

- عند وضع قطرات من محلول اليود في انبوبة تحتوي
على محلول النشا يتحول لون اليود البني إلى اللون الازرق
* حلل العلاقات البيانية ثم أجب :

قام باحث كيميائي برصد حركة جزيئات مواد مختلفة وهي
(الاكسجين - النحاس - الماء )
- مادة النحاس يمثلها العمود رقم ( 1 )
السبب: لأن المسافة بين جزيئات المادة الصلبة صغيرة جدا.
و الشكل المقابل يمثل نموذج ذرة الألمونيوم:
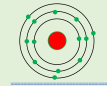
تحتوي ذرة الألمونيوم على ( ١٣) الكترون
*حلل العلاقات البيانية ثم أجب

الشكل البياني يوضح قوة الترابط بين جزيئات الماء في حالات مختلفة
( بخار الماء- ماء- ثلج)
المادة التي لها حجم ثابت وشكل متغير يمثلها العمود رقم ( ٣)
تتحرك جزيئات المادة رقم ( 1) بحركة اهتزازية
* الشكل المقابل يمثل توزيع الالكترونات حول ذرة عنصر لا فلزي.
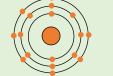
ينتمي هذا العنصر إلى عناصر الدورة ( ۳)
لكي يصل هذا العنصر إلى الاستقرار عند ارتباطه بذرة أخرى يكتسب أم يفقد الكترون ؟ يكسب
*و حل المسألة التالية:
احسب العدد الكتلي الذرة ما إذا علمت أن عدد الالكترونات يساوي ( ۱۲) وعدد النيترونات يساوي ( ١٢)
القانون: العدد الكتلي- عدد النيترونات- عدد البروتونات) الذي يساوي عدد الالكترونات)
الحل: العدد الكتلي=١٣- ١٢- ٢٤
