انفوجرافيك وحدة المادة علوم ثامن فصل أول #أ. دانة العنزي 2024-2025
حالات المادة
| صلبة | سائلة | غازية |
| حركتها اهتزازية حجمها وشكلها ثابت | حركتها انتقالية فوق بعضها البعض حجمها ثابت وشكلها متغير | حركتها عشوائية في جميع الاتجاهات حجمها وشكلهامتغير |
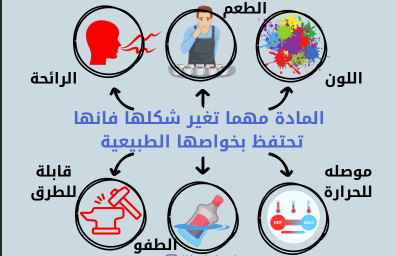
المادة مهما تغير شكلها فانها تحتفظ بخواصها الطبيعية
تركيب الذرة
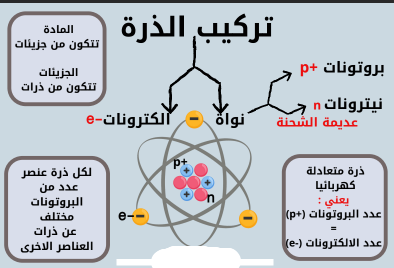
أهم القوانين
العدد الذري = عدد البروتونات (+p)
العدد الكتلي = عدد البروتونات (+p )+ عدد النيترونات (n)
عدد البروتونات (+p) = عدد االلكترونات (-e)
7 مستويات للطاقة
المستوى الأول يتسع لإلكترونين فقط
المستوى الثاني يتسع لـ 8 الإكترونات فقط ومازاد عن ذلك يدخل في المستوى الثالث
طريقة توزيع الالكترونات
X العدد الكتلي العدد الذري |
,.......المستوى الثاني,8 المستوى الأول2 : رمز العنصر …….X : 2 , 8
 العدد الذري = (+p )= 11 العدد الكتلي = (p+n )=23 عدد النيترونات n= (العدد الكتلي - p )= 12 Na : 2,8,1 |  العدد الذري = (+p) = 3 العدد الكتلي = (p+n) = 7 عدد النيترونات n = (العدد الكتلي - p ) = 4 Li : 2,1 |
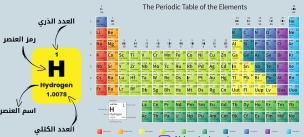
الجدول الدوري الحديث
جدول تظهر فيه خواص العناصر في نموذج متكرر و منتظم
يتكون من :
7 صفوف افقية ( الدورة ) و18 عمود راسي ( مجموعة ) 8A - 10B

1- رتبت العناصر حسب الزيادة في العدد الذري من جهة اليسار الى جهة اليمين.
2- تزيد كل ذرة بروتون واحد عن الذرة التي تسبقها.
3- عناصر المجموعة الواحدة تتشابه في : خواصها الكيميائية والكترونات المستوى الخارجي .
4- تنخفض الخاصية الفلزية من اليسار الى اليمين .
5- عدد الدورات في الجدول الدوري يساوي عدد مستويات الطاقة .
6- اذا تشابهت العناصر في عدد الكترونات المستوى الخارجي فانها تتشابه في خواصها الكيميائية .
7- الالنثانيدات :تخرج من الدورة السادسة.
8- الاكتتينيدات : تخرج من الدورة السابعة.
نحدد موقع العنصر
عدد الكترونات المستوى الخارجي (رقم المجموعة)
عدد المستويات في ذرة العنصر (رقم الدورة)
 Na : 2,8,1 عدد مستويات الطاقة = 3 الكترونات المستوى الخارجي = 1 يقع العنصر في الدورة الثالثة المجموعة الاولى |  Li : 2,1 عدد مستويات الطاقة = 2 الكترونات المستوى الخارجي = 1 يقع العنصر في الدورة الثانية المجموعة الاولى |
الغازات النبيلة هي العناصر التي يكون المستوى الخارجي لها مستقر بالالكترونات
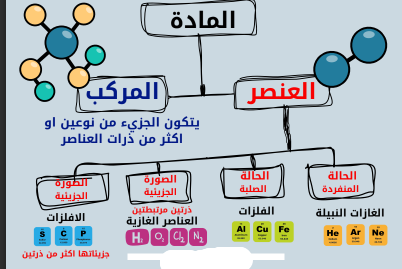
المادة
الرابطة الكيميائية
هي قوة التماسك التي تربط بين الذرات او الأيونات ببعضها البعض
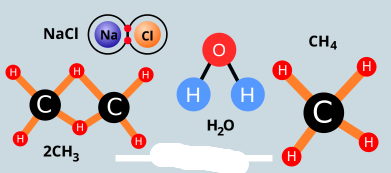
الرابطة االيونية
هي قوة تجاذب الكهرباء الساكنة بين الايونات المختلفة في نوع الشحنات
| الذرات التي تفقد الكترونات تصبح شحنتها موجبة تسمى ايون موجب | الذرات التي تكتسب الكترونات تصبح شحنتها سالبة تسمى ايون سالب |
| أيون موجب | أيون سالب |
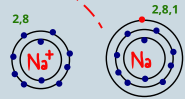 ذرة الصوديوم فقدت الكترون حتى تصل لحاله الاستقرار فاصبحت الذرة ايون موجب الشحنة حجم الايون الموجب اصغر من حجم الذرة | 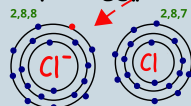 ذرة الكلور اكتسبت الكترون حتى تصل لحاله الاستقرار فاصبحت الذرة ايون سالب الشحنة حجم الايون السالب اكبر من حجم الذرة |
