بنك أسئلة محلول لوحدة المادة علوم ثامن فصل أول #التوجيه العام 2023 2024
السؤال الأول: اختر الإجابة الصحيحة علميا لكل من العبارات التالية وضع علامة (صح) في المربع المقابل لها:
1- مادة جزيئاتها مترابطة تتحرك حركة اهتزازية في مكانها:
الصلبة
السائلة
الغازية
البلازما
2- مادة جزيئاتها مترابطة تتحرك حركة انتقالية:
الصلبة
السائلة
الغازية
البلازما
3- مادة تتميز بضعف الترابط بين جزيئاتها و حركتها انتقالية عشوائية سريعة في جميع الاتجاهات:
الصلبة
السائلة
الغازية
البلازما
4- الرسم المقابل يوضح شكل الجزيئات:

ثاني اكسيد الكربون
الحديد والخشب
الماء والزيت
الهيدروجين والأكسجين
5- المواد التالية موصلة جيدة للمرارة والكهرباء ماعدا:
الحديد
النحاس
الكبريت
الالومينوم
6-الرسم البياني الذي يوضح العلاقة بين سرعة حركة الجزيئات والطاقة المكتسبة:

7- الشكل المقابل عدد البروتونات في ذرة الصوديوم:

32
11
12
23
8-رمز الجسيم السالب الشحنة في الذرة:
n
e
p
b
9-رمز الجسيم عديم الشحنة في الذرة:
n
e
p
b
تابع/ السؤال الأول: اختر الإجابة الصحيحة علميا لكل من العبارات التالية وضع علامة (صح) في المربع المقابل لها:
10-يرمز للجسيم الموجب الشحنة في الذرة بالرمز:
n
e
p
b
11- يطلق على مجموع عدد البروتونات والنيوترونات في نواة ذرة ما بالعدد:
الكتلي
الذري
الالكترونات
النيوترونات
12-تحتوي معظم أنوية الذرات على:
نيوترونات فقط
بروتونات والكترونات
بروتونات ونيوترونات
نيوترونات والكترونات
13- الذرة ( X) تحتوي على ( 15) بروتون فإن عدد الالكترونات في الذرة تساوي:
15
14
16
31
14-معظم كتلة الذرة تتركز في:
النواة
الاكترونات
النيوترونات
البروتونات
15-عند البروتونات في نواة ذرة عنصر الليثيوم Li 7 *3
3
4
12
16
16- تعتبر من خواص الحديد والالمنيوم
قابلة للطرق والسحب
رديئة التوصيل للكهرباء
غير قابلة للطرق والسحب
رديئة التوصيل للحرارة
17- العدد الذري للذرة في الشكل المقابل يساوي
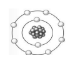
8
4
10
5
18- عدد الإلكترونات في مستوى الطاقة الثاني في ذرة النيتروجين ( N7) يساوي
7
6
5
2
19-عدد دور ات الجدول الدوري
4
5
7
3
20-عدد مجموعات الجدول الدوري
12
14
18
11
21-تنشأ الرابطة الايونية بين:
فلز ولا فلز
فلز وغاز خامل
فلز وفلز
لافلز ولافلز
22- كلما اتجهنا يمين الجدول الدوري فإن
العدد الذري يزيد
العدد الذري يقل
العدد الذري= العدد الكتلي
العدد الكتلي يقل
23-الشكل المقابل موقع العنصر في الجدول الدوري:
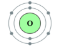
الدورة 1 المجموعة 1
الدورة2 المجموعة6
الدورة2 المجموعة 2
الدورة3 المجموعة 6
24-عند اكتساب ذرة العنصر الكترونين فإنها تصبح مشحونة بـ:
شحنة سالبة
شحنتين سالبتين
شحنة موجبة
شحنتين موجبتين
25-عند تفقد ذرة العنصر الكترون فإنها تصبح مشحونة بـ:
شحنة سالبة
شحنتين سالبتين
شحنة موجبة
شحنتین موجبتين
26- العنصر الذي يقع في الدورة الثانية يحتوي على عدد ذري يساوي:
8
14
2
20
السؤال الثاني: اكتب بين القوسين كلمة ( صحيحة) للعبارة الصحيحة وكلمة ( خطأ) للعبارة غير الصحيحة علميا في كل مما يأتي:
1- جزيئات المركب الواحد متشابهة في خواصها الطبيعية ( صحيحة )
2- المسافة الجزيئية بين جزيئات الخشب أكبر من المسافة الجزيئية بين جزيئات العصير. (خطأ)
3- العدد الذري يمثل عند النيوترونات داخل نواة ذرة العنصر. (خطأ)
4-تتحرك الإلكترونات بسرعة عالية جداً في مستويات محددة حول نواة الذرة. ( صحيحة )
5- كتلة البروتون تساوي كتلة الإلكترون وأصغر من كتلة النيوترون (خطأ)
6- يمتلك الإلكترون شحنة سالبة بينما البروتون شحنته موجبة. ( صحيحة )
7-ترابط ذرات المادة في عصير البرتقال أقوى من ترابطها في قطعة الحديد. (خطأ)
8- جزيئات المادة في الحالة الصلبة تتحرك حركة انتقالية حيث تنزلق فوق بعضها البعض (خطأ)
9- عدد الالكترونات السالبة في الذرة المتعادلة يساوي عدد البروتونات الموجبة. ( صحيحة )
10- كلما اكتسبت جزيئات المادة طاقة تصبح حركتها أقل. (خطأ)
11-تتركز كتلة الذرة في النواة لأنها تضم البروتونات والنيوترونات. ( صحيحة )
12- الذرة هي أصغر وحدة بنائية للعنصر. ( صحيحة )
13- يعتبر عنصر الكربون من العناصر غير قابلة لطرق والسحب.( صحيحة )
14- الصفوف الأفقية في الجدول الدوري تسمى المجموعات. (خطأ)
15- الأعمدة الراسية في الجدول الدوري تسمى المجموعات. ( صحيحة )
16- يحتوى الجدول الدوري على ٧ صفوف. ( صحيحة )
17- يحتوى الجدول الدوري على ١٦ مجموعة. (خطأ)
18- يقع العنصر الذي عنده الذري ( 5) في الدورة الثانية والمجموعة 3A ( صحيحة )
19- إذا كان العنصر X يقع في المجموعة 4A فإن لديه ثلاث إلكترونات في المستوى الأخير (خطأ)
20- العناصر النبيلة هي التي تقع في المجموعة 6A (خطأ)
21- الشكل المقابل ، تعتبر الذرة في من العناصر الفلزية. (خطأ)

22- عناصر المجموعة الثامنة ( غازات خاملة) لا تكون روابط كيميائية بسهولة. ( صحيحة )
23- معظم العناصر اللافلزية لديها القابلية لاكتساب الالكترونات. ( صحيحة )
السؤال الثالث: في الجدول التالي اختر العبارة أو الشكل من المجموعة ( ب) واكتب رقمها أمام ما يناسبها من عبارات المجموعة ( أ):
| الرقم | المجموعة(أ) | المجموعة (ب ) |
3 1 | ذرة فقدت ثلاث إلكترونات: ذرة اكتسبت ثلاث إلكترونات: |  |
2 1 | عنصر من الغازات النبيلة: عنصر يقع في المجموعة 3A |  |
1 3 | التوزيع الالكتروني الصحيح لذرة 17Cl : التوزيع الالكتروني الصحيح لذرة 10Ne | 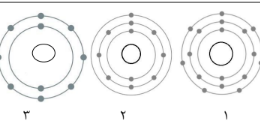 |
1 2 | (1 ، 8 ، 2 ) التوزيع الالكتروني لـ : (3 ، 8 ، 2 ) التوزيع الالكتروني لـ | 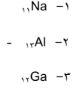 |
2 1 | عنصر يقع في المجموعة الاولى: عنصر يقع في المجموعة الثالثة: | 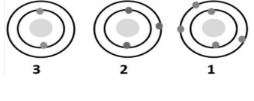 |
السؤال الرابع علل لما يلي تعليلا علميا سليما:
1- المادة في الحالة الصلبة لها شكل ثابت.
الجواب : لأن جزيئاتها مترابطة وتتحرك حركة اهتزازية في مكانها.
2-تختفي قطرات العطر بعد وضعها دقائق في زجاجة ساعة.
الجواب : جزئيات العطر سريعة التطاير وبالتالي تتبخر بسرعة وتنتشر في الهواء.
3-الذرة متعادلة كهربائيا.
الجواب : عدد البروتونات الموجبة تساوى عدد الالكترونات السالبة.
4-ترتكز كتلة الذرة في النواة.
الجواب : لوجود البروتونات والنيوترونات.
5-نواة الذرة موجبة الشحنة.
الجواب : تحتوي على البروتونات موجبة الشحنة والنيوترونات عديمة الشحنة.
6- يعتبر الماء ( H2O) مركب.
الجواب : يتكون من ذرات عناصر مختلفة.
7-تطفو بعض المواد على سطح الماء.
الجواب : المواد الأقل كثافة من كثافة الماء تطفو على سطحه.
8-المادة في الحالة الصلبة لها شكل وحجم ثابت
الجواب : جزيئاتها مترابطة وتتحرك حركة اهتزازية في مكانها.
9-يغوص الحديد في الماء
الجواب : كثافتها أكبر من كثافة الماء.
10-يستخدم عنصر النحاس في صناعة أسلاك الكهرباء
الجواب : من العناصر الموصلة للكهرباء.
11-عند وضع سائل في وعاء فأن السائل يأخذ شكل الوعاء.
الجواب : جزيئات السائل متوسطة الترابط وتتحرك حركة انزلاقية فوق بعضها البعض.
12-يقع الليثيوم ( 3 Li ) في الدورة الثانية المجموعة الأولى
الجواب : عدد مستويات الطاقة اثنان إذن الدورة الثانية والمستوى الخارجي يحتوى على إلكترون واحد
13- نتشابه خواص عنصر الصوديوم ( N11) مع عنصر البوتاسيوم (K19)
الجواب : لأن كلا منهم في المجموعة الأولى لاحتواء المستوى الخارجي على إلكترون واحد.
14-غاز النيون. 10Ne لا يدخل في روابط كيميائية مع عناصر أخرى
الجواب : لأن مستوى الطاقة الأخير مشبع بالإلكترونات أي أنه مستقر.
15- عناصر المجموعة الواحدة نتشابه في الخواص الكيميائية.
الجواب : لأن المستوى الاخير تتساوي به عدد الإلكترونات الخارجية
16- ذرات الغازات النبيلة لا تكون روابط بسهولة
الجواب : لأن المستوي الاخير مكتمل ومستقر.
السؤال الخامس: أي مما يلي لا ينتمي للمجموعة ، مع ذكر السبب:

الذي لا ينتمي: الكبريت
السبب : مادة رديئة التوصيل للحرارة والكهرباء
والباقي من: مواد موصلة للحرارة والكهرباء
2- الحديد- النحاس- الذهب- الخشب
الذي لا ينتمي: الخشب
السبب : من المواد غير موصلة للكهرباء
والباقي من: المواد الموصل للكهرباء
3-زجاج- حديد- بخار ماء – خشب
الذي لا ينتمي: بخار ماء
السبب : الحالة الغازية
والباقي من: الحالة الصلبة
السؤال السادس: ماذا يحدث في كل حالة من الحالات التالية:
1-عند رش العطر في زاوية المختبر.
الجواب : تنتشر رائحة العطر لأن جزيئات المادة في حركة مستمرة العطر و تنتشر بين جزيئات الهواء.
2-عند وضع كيس شاي في كأس يحتوي ماء ساخن.
الجواب : ينتشر الشاي في الماء/ ويتغير لون وطعم ورائحة الماء لأن جزيئات الشاي تنتشر فالمسافات البينية لجزيئات الماء.
3- عند وضع القطرة من الحبر في كأس به ماء
الجواب : تلون الماء بلون الحبر لان الجزيئات في حالة حركة مستمرة ( انتشار الحبر )
4-عند وضع قطعة من الفلين على سطح الماء.
الجواب : يطفو الفلين على سطح الماء.
5- عند اتحاد ذرات من عناصر مختلفة مع بعضها البعض.
الجواب : يتكون مركب
6- عند زيادة عدد البروتونات في الذرة عن عدد الإلكترونات.
الجواب : تصبح الذرة غير متعادلة كهربائيا.
7-عندما تكتسب ذرة العنصر اللافاز الكترون أو أكثر.
الجواب : تصبح ايون سالب ويصبح حجمها أكبر.
السؤال السابع: قارن بين كل مما يلي كما هو موضح في الجدول التالي:
| وجه المقارنة | 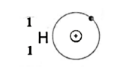 | 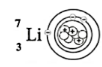 |
| عدد الربوتونات | 1 | 3 |
| عدد الإلكترونات | 1 | 3 |
| عدد النيترتونات | صفر | 4 |
| العدد الذري | 1 | 3 |
| العدد الكتلي | 1 | 7 |
| وجه المقارنة | البروتونات | الإلكترونات | النيترتونات |
| الرمز | p | e | n |
| الكتلة | كبيرة نسبا | صغيرة جدا | كبيرة نسبيا |
| الشحنة الكهربائية | موجبة | سالبة | متعادلة / عديمة |
| مكان تواجده في الذرة | النواة | تدور حول النواة | النواة |
| وجه المقارنة | حالة الصلبة | حالة السائلة | حالة الغازية |
| الشكل | ثابت | متغير | متغير |
| الحجم | ثابت | ثابت | متغير |
| حركة الجزيئات | اهتزازية بسيطة | انزلاقية / انتقالية | عشوائية |
| قوة الترابط | قوية | مترابطة | ضعيفة الترابط |
تابع / السؤال السابع: قارن بين كل مما يلي كما هو موضح في الجدول التالي:
| وجه المقارنة | 17Cl | 3Li |
| التوزيع الالكتروني | 2-8-7 | 2-1 |
| المجموعة | 7 | 1 |
| الدورة | 3 | 2 |
| نوع ذرات العنصر ( فلز - لا فلز ) | لافلز | فلز |
| وجه المقارنة | الدوراات | المجموعات |
| مسمى آخر | صفوف | اعمدة |
| عددها في الجدول الدوري | 7 | 18 |
| مع زيادة العدد الذري الخاصية الفلزية (تقل/ تزداد) | تقل | تزداد |
| مع زيادة العدد الذري الخاصية اللافلزية (تقل/ تزداد) | تزداد | تقل |
| تشابهه العناصر الكيميائية فيها | عدد مستويات الطاقة | عدد الكترونات المستوى الخارجي |
السؤال الثامن: أمامك مجموعة من التجارب أجريتها في المختبر ادرسها جيدا واجب عن المطلوب
1- الشكل المقابل ، تم مزج السائلين في المخبار المدرج

الملاحظة: انتشر الكحول في الماء وأصبح حجمه اقل من 500 سم
التفسير: : يدل النقص في الحجم على ان هناك مسافات سمحت بانتشار الكحول
2- عند وضع كيس شاي في كوب ماء ساخن:

الملاحظة: يختلط الشاي مع الماء
التفسير:المادة تتكون من جزيئات تحتفظ بخواص المادة الطبيعية ويوجد مسافات بينها
السؤال التاسع: ادرس الرسومات التالية جيدا ثم أجب عن المطلوب:
1-الرسم البياني قام به مركز بحوث علمية برصد حركة جزيئات مواد مختلفة الثاني أكسيد الكربون- نحاس- خل) والمسافات بين جزيئاتها.
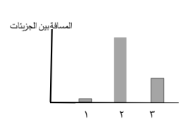
- العمود رقم (1) يمثل نحاس. والسبب: المسافات بين جزيئاتها قليلة جدا.
- العمود رقم (2) يمثل .ثاني أكسيد الكربون و السبب جزيئاتها متباعدة جدا.
- العمود رقم (3) يمثل خل و السبب جزيئاتها متوسطة التباعد و تأخذ شكل الاناء الذي توضع فيه.
2-شاهد ناصر برنامج تليفزيوني عن الماء وعرف أن الماء المركب الوحيد الذي يوجد في حالات المادة الثلاثة ، وقام برسم جزيئات الماء في الحالات الثلاث وأخطأ في كتابة أسم الحالة تحت الرسم صحيح الخطأ

- الشكل ( B ) الحالة الغازية
- الشكل ( A ) الحالة السائلة
- الشكل ( C) الحالة الصلبة
- تصحيح الخطأ: (A ) الماء في الحالة الصلبة - (B ) الماء في الحالة الغازية - (C ) الماء في الحالة السائلة
3-الشكل المقابل بمثل ذرا عصر 17CI
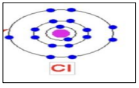
حدد على الذرة التوزيع الالكتروني
عدد البروتونات= (17)
عند الالكترونات= (.17.)
العدد الذري= (.17)
4-الشكل المقابل يوضح التوزيع الالكتروني العنصر الصوديوم
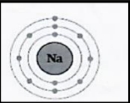
- يقع عنصر الصوديوم في الدورة رقم (.3.)
يقع عنصر الصوديوم في المجموعة رقم ( 1 )
5-الشكل المقابل يوضح الجدول الدوري

عدد الصفوف الأفقية في الجدول الدوري الحديث: (7.)
عند الأعمدة الرأسية في الجدول الدوري الحديث: (.18)
السؤال العاشر: حل المسائل التالية:
1- احسب العدد الكتلي لذرة ما إذا علمت بأن عدد الإلكترونات يساوي ( ۱۲) وعدد الديوترونات ( ۱۲)
القانون: العدد الكتلي = عدد النيوترونات + عدد البروتونات ( عدد الالكترونات )
الحل: العدد الكتلي = 12 + 12 = 24
السؤال الحادي عشر: أكمل الناقص في الجدول التالي:
| العنصر | العدد الذري | العدد الكتلي | عدد P | عدد e | عدد n |
 | 51 | 121 | 51 | 51 | 70 |
 | 47 | 107 | 47 | 47 | 60 |
 | 16 | 32 | 16 | 16 | 16 |
 | 20 | 40 | 20 | 20 | 20 |
1- ضع العناصر التالية في المكان المناسب لها بالجدول
( 12Mg - 4Be - 2He - 8O - 7N - 16S - 3Li - 14Si)

السؤال الثاني عشر صنف كال مما يلي كما هو موضح في الجدول التالي:
1- صنف المواد (الحديد – كلوريد الصوديوم –– صدأ الحديد- المغنيسيوم)
| عنصر | مركب |
| المغنيسيوم -الحديد | كلوريد الصوديوم – صدأ الحديد |
