نقدم لكم كتاب الكيمياء للصف الحادي عشر الفصل الاول يتضمن الملف حل الأنشطة والتقويم
كتاب الكيمياء للصف الحادي عشر الفصل الاول بإمكانكم تحميل هذا الملف على شكل بي دي إف PDF جاهز للتشغيل على أي جهاز لوحي أو إلكتروني أو كمبيوتر عن طريق زر التحميل في الأعلى كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة
المحتويات
الوحدة الأولى: الإلكترونات في الذرة
الفصل الاول : الافلاك الجزئية
الدرس 1 : الأفلاك الجزيئية
الفصل الثاني : الافلاك المهجنة
الدرس 2 : الأفلاك المهجنة
مراجعة الوحدة الأولى
الوحدة الثانية: المحاليل
الفصل الاول : المحاليل المائية المتجانسة و غير متجانسة
الدرس 1 : الماء كمذيب قوي
الدرس 2 : المحاليل المائية
الدرس 3 : الأنظمة المائية غير المتجانسة
الفصل الثاني : الخواص العامة لللمحاليل المتجانسة
الدرس 1 : التفاعلات في المحاليل المائية
الدرس 2 : العوامل المؤثرة على الذوابانية في المحاليل
الدرس 3 : تركيب المحاليل
الدرس 4 : الحسابات المتعلقة بالخواص المجتمعة للمحاليل
مراجعة الوحدة الثانية
أسئلة مراجعة الوحدة الثانية
الوحدة الثالثة: الكيمياء الحرارية
الفصل الاول : الكيمياء الحرارية
الدرس 1 : التغيرات الحرارية
مراجعة الوحدة الثالثة
مقدمة
الحمدالله رب العالمين، والصلاة والسلام على سيد المرسلين، محمد بن عبداالله وصحبه
أجمعين. عندما شرعت وزارة التربية في عملية تطوير المناهج، استندت في ذلك إلى جملة
من الأسس و المرتكزات العلمية والفنية والمهنية، حيث راعت متطلبات الدولة وارتباط
ذلك بسوق العمل، وحاجات المتعلمين و التطور المعرفي و العلمي، بالإضافة إلى جملة من
التحديات التي تمثلت بالتحدي القيمي و الاجتماعي و الاقتصادي و التكنولوجي و غيرها،
وإن كنا ندرك أن هذه الجوانبلها صلة وثيقة بالنظام التعليمي بشكل عام وليس المناهج
بشكل خاص.
و لقد كانت مناهج العلوم و الرياضيات من أول المناهج التي بدأنا بها عملية التطوير، إيمانًا
بأهميتها ً و انطلاقا من أنها ذات صفة عالمية، مع الأخذ بالحسبان خصوصية المجتمع الكويتي
وبيئته المحلية، وعندما أدركنا أنها تتضمن جوانب عملية التعلم ونعني بذلك المعرفة
والقيم والمهارات، قمنا بدراستها وجعلها تتوافق مع نظام التعليم في دولة الكويت،
مركزين ليس فقط على الكتاب المقرر ولكن شمل ذلك طرائق وأساليب التدريس والبيئة
التعليمية ودور المتعلم، مؤكدين على أهمية التكامل بين الجوانب العلمية والتطبيقية
حتى تكون ذات طبيعة وظيفية مرتبطة بحياة المتعلم.
الالكترونات بالذرة
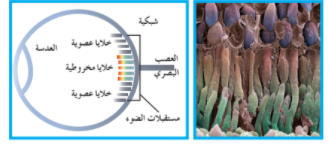
يظهر مقطع من شبكة العين البشرية مستقبلات الضوء وهي بمثابة جامع للضوء اذا تمكنا من تكبير الأحداث الجزيئية التي تحدث في مستقبلات الضوء سوف نرى جزيئات تغير أشكالها عند وقوع الضوء عليها . هذا التغيير في الشكل هو الخطوة الأولى في عملية تُسمى النظر و لكن ما
الذي يسيطر على أشكال الجزيئات ؟
اكتشف بنفسك :
تشكيل نماذج الجزيئات الكيميائية
لإجراء هذا النشاط يجب توافر ما يلي : علبة نماذج ذرات يمكن الحصول عليها من معلم الفصل
جدول دوري، قلم ، ورقة
1 _ ارسم الترتيب النقطي لجزيئي الماء و ثاني اكسيد الكربون
2 _ اصنع نموذجاً ثلاثي الأبعاد لكل من هذين الجزيئين. استخدم الكرات بحسب الألوان المتعارف عليها ، ًمثلا :
3 _ .ارسم الشكل الهندسي الذي تتوقعه لكل من هذين لجزيئتين
4 _ كرر الخطوات 1 و 2 و 3 للجزيئات H .4 2 ، HCl ، NH3 ، CH4
5 _ .ما هي طبيعة الجزيئات التي اخترناها في هذا النشاط ؟
6 _ هل تتشابه الجزيئات التي تحوي نفس عدد الذرات ؟
الأفلاك الجزيئية
تعلمت في السنة السابقة ان ذرات العناصر تميل لأن ترتبط ببعضها بعضا لتكون المركبات فتتكون المواد من ذرات مرتبطة ببعضها البعض بقوى تجاذب تعرف بالروابط الكيميائية (الأيونية، التساهمية، التساهمية التناسقية) و تعرفت اايضا بالروابط الكيميائية (الأحادية، الثنائية، الثلاثية)
تعود فكرة الترابط التساهمي إلى جيلبرت لويس الذي وصف الرابطة التساهمية بأنّها مساهمة أزواج الإلكترونات بين الذرات يفترض نموذج لويس للرابطة التساهمية ّ أن ّكل زوج من إلكترونات الترابط يقع بين الذرتين المترابطتين. ولكن، نعلم أنّه لا يمكن تحديد مكان الإلكترون وسرعته بدقة تامة في الوقت نفسه ّلأن الحركة الموجية للإلكترون ليس لها مكان محدد. يخضع تحديد مكان الإلكترون لقوانين الاحتمالات.
تسمى منطقة الفراغ المحيطة بنواة الذرة والتي يتواجد فيها الإلكترون بالفلك الذري و يسمى
وصف الرابطة التساهمية من خلال الأفلاك الذرية بنظرية رابطة التكافؤ

الافلاك الجزيئية
الاهداف العامة
* يستنبط نظرية رابطة التكافؤ .
* يذكر نظرية الفلك الجزيئي.
* يستخلص مفهوم تكوين الرابطة سيجما σ والرابطة باي π.
فقرة اثرائية :
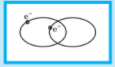
في نظرية رابطة التكافؤ ، الإلكترونات تشغل الأفلاك الذرية في الجزيئات
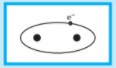
في نظرية الفلك الجزيئي، الإلكترونات تشغل الأفلاك الجزيئية
فقرة إثرائية
مصدرالرابطة سيجما "σ" يوازي الحرف اليوناني σ سيجما الحرف اللاتيني s . يذكر حرف
s بأن توزيع الإلكترونات على المحور الذي يصل النواتين المترابطتين يكون على شكل الفلك s.
1 _ أنواع التداخل
أ _ التداخل المحوري - ارابطة σ :
تنتج الرابطة التساهمية سيجما σ Sigma Bond عن تداخل فلكي ذرتين رأساً لرأس تتوزع الكثافة الإلكترونية بشكل متماثل على طول المحور الذي يصل بين نواتي الذرتين المترابطتين. كما أن الكثافة الإلكترونية تزداد بين النواتين فيما تقل خارجهما
أي الأفلاك يشهد تداخلا محوري Axial Overlapping ؟
(أ) تداخل فلكين s : بنية جزيء الهيدروجين :
يعتبر جزيء الهيدروجين من أبسط الجزيئات تملك ذرة الهيدروجين إلكترون في الفلك 1s كروي الشكل و الذي يحيط بنواة ذرة الهيدروجين (الوضع الأدنى طاقة للذرة )
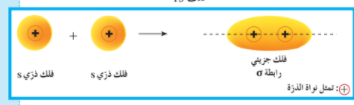
عندما تقترب ذرتا هيدروجين من بعضهما بعضا لتكوين جزيء الهيدروجين H2 ، يتداخل الفلكان 1s حيث تتواجد الإلكترونات رأساً لرأس ينتج عن هذا التداخل فلك جزيئي يحيط بنواتي ذرتي الهيدروجين شكل 2 ، تسمى الرابطة الناتجة عن هذا التداخل الرابطة سيجما σ
(ب) تداخل فلك s مع فلك p : بنيةكلوريد الهيدروجين
يظهر الترتيب الإلكتروني لكل من ذرتي H و Cl ما يلي :
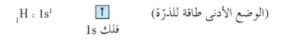
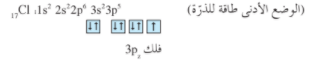
يشغل الإلكترون المنفرد في ذرة الهيدروجين الفلك الذري 1s ( كروي الشكل) ، فيما يشغل الإلكترون المنفرد في ذرة الكلور الفلك الذري 3pz (بيضاوي الشكل)
عندما تتشارك ذرة الهيدروجين و ذرة الكلور هذين الإلكترونين ، يتداخل الفلك 1s والفلك 3pz رأساً لرأس لتكوين رابطة تساهمية سيجما σ على طول المحور pz) شكل 3

(ج) تداخل فلكي p : بنية جزيء الكلور
يظهر الترتيب الإلكتروني لذرة الكلور ما يلي :
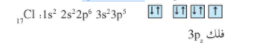
يشغل الإلكترون المنفرد في كل من ذرتي الكلور الفلك 3pz ( بيضاوي الشكل) وعندما تتشارك ذرتي الكلور الإلكترونين المنفردين ، يتداخل الفلكان pz رأساً لرأس لتكوين رابطة تساهمية σ على طول المحور pz _ pz ( شكل 4 )
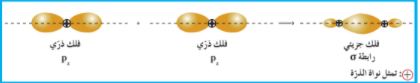
خواص الرابطة التساهمية سيجما σ
- هي كل رابطة تساهمية أحادية في الكيمياء
- يكون محور تداخل الفلكين محور التناظر
- تكون هذه الرابطة أقوى كلما كان التداخل أكبر
- تعمد طاقة الرابطة سيجما σ على المسافة بين الذرتين المترابطين وعلى عدد الروابط التي تشكلها هاتان الذرتان
2_ التدخل الجانبي : الرابطة باي π
يتداخل الفلكان في هذه الحالة جنباً إلى جنب عندما يكون محورا الفلكين متوازيين ليتكون فلك جزيئي ، تنتج عن هذا التداخل الجانبي Side by Side Overlapping الرابطة التساهمية باي Pi-bond π لا يتكون هذا النوع من الروابط ألا إذا سبقته الرابطة سيجما σ ، تعتبر بنية جزيء النيتروجين أفضل مثال لدراسة الرابطة باي π
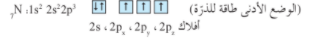
يظهر الترتيب الإلكتروني لذرة عنصر النيتروجين ما يلي :
:

